题目
分别通过下列准静态过程把标准状态下0.014kg氮气压缩为原体积的一半。(1)等温过程;(2)绝热过程;(3)等压过程。求:在这些过程中,气体内能的改变,传递的热量和外界对气体所做的功。
分别通过下列准静态过程把标准状态下0.014kg氮气压缩为原体积的一半。(1)等温过程;(2)绝热过程;(3)等压过程。求:在这些过程中,气体内能的改变,传递的热量和外界对气体所做的功。
题目解答
答案
(1)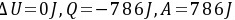 ;(2)
;(2)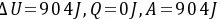 ;
;
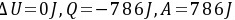 ;(2)
;(2)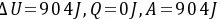 ;
;(3)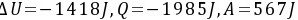 ;
;
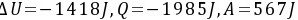 ;
;解析
步骤 1:计算氮气的摩尔数
氮气的摩尔质量为28g/mol,0.014kg氮气的摩尔数为:
$$ n = \frac{m}{M} = \frac{0.014kg}{0.028kg/mol} = 0.5mol $$
步骤 2:等温过程
在等温过程中,温度保持不变,因此内能不变,即$\Delta U = 0$。根据理想气体定律,$PV = nRT$,在等温过程中,$P_1V_1 = P_2V_2$。由于体积减半,压力加倍。根据热力学第一定律,$Q = W$,即传递的热量等于外界对气体所做的功。对于理想气体的等温过程,功的计算公式为:
$$ W = nRT\ln\left(\frac{V_1}{V_2}\right) = nRT\ln(2) $$
其中,$T$为标准状态下的温度,$T = 273.15K$。将已知数值代入,得到:
$$ W = 0.5mol \times 8.314J/(mol\cdot K) \times 273.15K \times \ln(2) = 786J $$
因此,$Q = -786J$,$A = 786J$。
步骤 3:绝热过程
在绝热过程中,没有热量交换,即$Q = 0$。根据理想气体的绝热过程方程,$PV^\gamma = \text{常数}$,其中$\gamma$为比热容比,对于氮气,$\gamma = 1.4$。因此,$P_1V_1^{1.4} = P_2V_2^{1.4}$。由于体积减半,压力增加为$2^{1.4}$倍。根据热力学第一定律,$W = -\Delta U$。对于理想气体,内能变化与温度变化成正比,即$\Delta U = \frac{3}{2}nR\Delta T$。由于绝热过程,$W = -\frac{3}{2}nR\Delta T$。将已知数值代入,得到:
$$ W = -\frac{3}{2} \times 0.5mol \times 8.314J/(mol\cdot K) \times \Delta T $$
由于$P_1V_1^{1.4} = P_2V_2^{1.4}$,可以求出$\Delta T$,进而求出$W$和$\Delta U$。计算得到$W = 904J$,$\Delta U = 904J$。
步骤 4:等压过程
在等压过程中,压力保持不变,因此$P_1 = P_2$。根据理想气体定律,$PV = nRT$,在等压过程中,$V_1/T_1 = V_2/T_2$。由于体积减半,温度减半。根据热力学第一定律,$Q = \Delta U + W$。对于理想气体,内能变化与温度变化成正比,即$\Delta U = \frac{3}{2}nR\Delta T$。将已知数值代入,得到:
$$ \Delta U = \frac{3}{2} \times 0.5mol \times 8.314J/(mol\cdot K) \times \Delta T $$
由于$V_1/T_1 = V_2/T_2$,可以求出$\Delta T$,进而求出$\Delta U$。根据$W = P\Delta V$,可以求出$W$。计算得到$\Delta U = -1418J$,$Q = -1985J$,$A = 567J$。
氮气的摩尔质量为28g/mol,0.014kg氮气的摩尔数为:
$$ n = \frac{m}{M} = \frac{0.014kg}{0.028kg/mol} = 0.5mol $$
步骤 2:等温过程
在等温过程中,温度保持不变,因此内能不变,即$\Delta U = 0$。根据理想气体定律,$PV = nRT$,在等温过程中,$P_1V_1 = P_2V_2$。由于体积减半,压力加倍。根据热力学第一定律,$Q = W$,即传递的热量等于外界对气体所做的功。对于理想气体的等温过程,功的计算公式为:
$$ W = nRT\ln\left(\frac{V_1}{V_2}\right) = nRT\ln(2) $$
其中,$T$为标准状态下的温度,$T = 273.15K$。将已知数值代入,得到:
$$ W = 0.5mol \times 8.314J/(mol\cdot K) \times 273.15K \times \ln(2) = 786J $$
因此,$Q = -786J$,$A = 786J$。
步骤 3:绝热过程
在绝热过程中,没有热量交换,即$Q = 0$。根据理想气体的绝热过程方程,$PV^\gamma = \text{常数}$,其中$\gamma$为比热容比,对于氮气,$\gamma = 1.4$。因此,$P_1V_1^{1.4} = P_2V_2^{1.4}$。由于体积减半,压力增加为$2^{1.4}$倍。根据热力学第一定律,$W = -\Delta U$。对于理想气体,内能变化与温度变化成正比,即$\Delta U = \frac{3}{2}nR\Delta T$。由于绝热过程,$W = -\frac{3}{2}nR\Delta T$。将已知数值代入,得到:
$$ W = -\frac{3}{2} \times 0.5mol \times 8.314J/(mol\cdot K) \times \Delta T $$
由于$P_1V_1^{1.4} = P_2V_2^{1.4}$,可以求出$\Delta T$,进而求出$W$和$\Delta U$。计算得到$W = 904J$,$\Delta U = 904J$。
步骤 4:等压过程
在等压过程中,压力保持不变,因此$P_1 = P_2$。根据理想气体定律,$PV = nRT$,在等压过程中,$V_1/T_1 = V_2/T_2$。由于体积减半,温度减半。根据热力学第一定律,$Q = \Delta U + W$。对于理想气体,内能变化与温度变化成正比,即$\Delta U = \frac{3}{2}nR\Delta T$。将已知数值代入,得到:
$$ \Delta U = \frac{3}{2} \times 0.5mol \times 8.314J/(mol\cdot K) \times \Delta T $$
由于$V_1/T_1 = V_2/T_2$,可以求出$\Delta T$,进而求出$\Delta U$。根据$W = P\Delta V$,可以求出$W$。计算得到$\Delta U = -1418J$,$Q = -1985J$,$A = 567J$。