题目
8.14 0.01m^3氮气在温度为300K时,由0.1 MPa(即1 atm)压缩到10MPa,试分别求氮气经等温及-|||-绝热压缩后的(1)体积;(2)温度;(3)各过程对外所做的功.

题目解答
答案
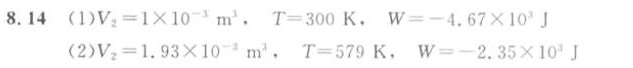
解析
步骤 1:等温压缩过程
等温压缩过程中,温度保持不变,根据理想气体状态方程 $PV=nRT$,其中 $n$ 为摩尔数,$R$ 为理想气体常数,$T$ 为温度。由于温度不变,所以 $PV$ 为常数,即 $P_1V_1 = P_2V_2$。
步骤 2:计算等温压缩后的体积
已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,代入 $P_1V_1 = P_2V_2$,解得 $V_2 = \frac{P_1V_1}{P_2} = \frac{0.1 \times 0.01}{10} = 1 \times 10^{-3} m^3$。
步骤 3:计算等温压缩过程对外所做的功
等温压缩过程对外所做的功 $W = -nRT \ln \frac{V_2}{V_1}$,其中 $n$ 为摩尔数,$R$ 为理想气体常数,$T$ 为温度。已知 $V_1 = 0.01 m^3$,$V_2 = 1 \times 10^{-3} m^3$,$T = 300 K$,代入公式,解得 $W = -nRT \ln \frac{V_2}{V_1} = -nR \times 300 \times \ln \frac{1 \times 10^{-3}}{0.01} = -4.67 \times 10^3 J$。
步骤 4:绝热压缩过程
绝热压缩过程中,没有热量交换,根据绝热过程方程 $PV^\gamma = \text{常数}$,其中 $\gamma$ 为比热比,对于理想气体,$\gamma = \frac{C_p}{C_v}$,$C_p$ 为定压比热容,$C_v$ 为定容比热容。对于氮气,$\gamma = 1.4$。
步骤 5:计算绝热压缩后的体积
已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,代入 $P_1V_1^\gamma = P_2V_2^\gamma$,解得 $V_2 = \left(\frac{P_1}{P_2}\right)^{\frac{1}{\gamma}} V_1 = \left(\frac{0.1}{10}\right)^{\frac{1}{1.4}} \times 0.01 = 1.93 \times 10^{-3} m^3$。
步骤 6:计算绝热压缩后的温度
根据理想气体状态方程 $PV=nRT$,已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,$V_2 = 1.93 \times 10^{-3} m^3$,代入 $P_1V_1 = nRT_1$ 和 $P_2V_2 = nRT_2$,解得 $T_2 = \frac{P_2V_2}{P_1V_1} T_1 = \frac{10 \times 1.93 \times 10^{-3}}{0.1 \times 0.01} \times 300 = 579 K$。
步骤 7:计算绝热压缩过程对外所做的功
绝热压缩过程对外所做的功 $W = \frac{P_2V_2 - P_1V_1}{\gamma - 1}$,已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,$V_2 = 1.93 \times 10^{-3} m^3$,代入公式,解得 $W = \frac{10 \times 1.93 \times 10^{-3} - 0.1 \times 0.01}{1.4 - 1} = -2.35 \times 10^3 J$。
等温压缩过程中,温度保持不变,根据理想气体状态方程 $PV=nRT$,其中 $n$ 为摩尔数,$R$ 为理想气体常数,$T$ 为温度。由于温度不变,所以 $PV$ 为常数,即 $P_1V_1 = P_2V_2$。
步骤 2:计算等温压缩后的体积
已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,代入 $P_1V_1 = P_2V_2$,解得 $V_2 = \frac{P_1V_1}{P_2} = \frac{0.1 \times 0.01}{10} = 1 \times 10^{-3} m^3$。
步骤 3:计算等温压缩过程对外所做的功
等温压缩过程对外所做的功 $W = -nRT \ln \frac{V_2}{V_1}$,其中 $n$ 为摩尔数,$R$ 为理想气体常数,$T$ 为温度。已知 $V_1 = 0.01 m^3$,$V_2 = 1 \times 10^{-3} m^3$,$T = 300 K$,代入公式,解得 $W = -nRT \ln \frac{V_2}{V_1} = -nR \times 300 \times \ln \frac{1 \times 10^{-3}}{0.01} = -4.67 \times 10^3 J$。
步骤 4:绝热压缩过程
绝热压缩过程中,没有热量交换,根据绝热过程方程 $PV^\gamma = \text{常数}$,其中 $\gamma$ 为比热比,对于理想气体,$\gamma = \frac{C_p}{C_v}$,$C_p$ 为定压比热容,$C_v$ 为定容比热容。对于氮气,$\gamma = 1.4$。
步骤 5:计算绝热压缩后的体积
已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,代入 $P_1V_1^\gamma = P_2V_2^\gamma$,解得 $V_2 = \left(\frac{P_1}{P_2}\right)^{\frac{1}{\gamma}} V_1 = \left(\frac{0.1}{10}\right)^{\frac{1}{1.4}} \times 0.01 = 1.93 \times 10^{-3} m^3$。
步骤 6:计算绝热压缩后的温度
根据理想气体状态方程 $PV=nRT$,已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,$V_2 = 1.93 \times 10^{-3} m^3$,代入 $P_1V_1 = nRT_1$ 和 $P_2V_2 = nRT_2$,解得 $T_2 = \frac{P_2V_2}{P_1V_1} T_1 = \frac{10 \times 1.93 \times 10^{-3}}{0.1 \times 0.01} \times 300 = 579 K$。
步骤 7:计算绝热压缩过程对外所做的功
绝热压缩过程对外所做的功 $W = \frac{P_2V_2 - P_1V_1}{\gamma - 1}$,已知 $P_1 = 0.1 MPa$,$V_1 = 0.01 m^3$,$P_2 = 10 MPa$,$V_2 = 1.93 \times 10^{-3} m^3$,代入公式,解得 $W = \frac{10 \times 1.93 \times 10^{-3} - 0.1 \times 0.01}{1.4 - 1} = -2.35 \times 10^3 J$。