题目
1 molH2气 ( 可看作理想气体 ) 等容下升温 H2 系统的H2= A 29.1 J B 20.8 J C 10.1 J D 无法确定
1 mol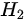 气 ( 可看作理想气体 ) 等容下升温
气 ( 可看作理想气体 ) 等容下升温 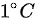 系统的
系统的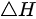 =
=
A 29.1 J
B 20.8 J
C 10.1 J
D 无法确定
题目解答
答案
答案:A
解析:
等容过程中,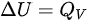 ,对于理想气体,
,对于理想气体,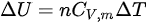 。
。
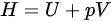 ,等容过程
,等容过程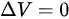 ,则
,则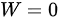 ,根据热力学第一定律
,根据热力学第一定律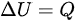 ,
,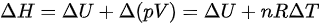 。
。
对于单原子理想气体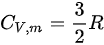 ,双原子理想气体
,双原子理想气体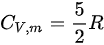 ,氢气是双原子分子,所以
,氢气是双原子分子,所以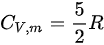 。
。
1mol 氢气等容升温 1°C,则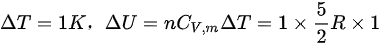
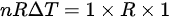 ,那么
,那么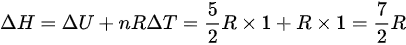
R取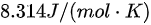 ,则
,则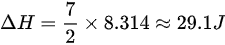 。
。
答案是 A。
解析
步骤 1:理解等容过程中的热力学关系
在等容过程中,体积保持不变,因此系统对外界不做功,即$W=0$。根据热力学第一定律,$\Delta U=Q-W$,在等容过程中,$\Delta U=Q$。对于理想气体,$\Delta U=nC_{V}m\Delta T$,其中$n$是物质的量,$C_{V}m$是摩尔定容热容,$\Delta T$是温度变化量。
步骤 2:计算$\Delta H$
对于理想气体,$\Delta H=\Delta U+\Delta (pV)$。在等容过程中,$\Delta (pV)=nR\Delta T$,其中$R$是理想气体常数。因此,$\Delta H=\Delta U+nR\Delta T$。对于双原子分子理想气体,${C}_{{V}_{2}m}=\dfrac {5}{2}R$,所以$\Delta H=n{C}_{{V}_{2}m}\Delta T+nR\Delta T=n(\dfrac {5}{2}R+R)\Delta T=\dfrac {7}{2}nR\Delta T$。
步骤 3:代入数值计算
对于1 mol的氢气,$n=1$,$\Delta T=1K$,$R=8.314 J/(mol\cdot K)$,所以$\Delta H=\dfrac {7}{2}\times 1\times 8.314\times 1\approx 29.1J$。
在等容过程中,体积保持不变,因此系统对外界不做功,即$W=0$。根据热力学第一定律,$\Delta U=Q-W$,在等容过程中,$\Delta U=Q$。对于理想气体,$\Delta U=nC_{V}m\Delta T$,其中$n$是物质的量,$C_{V}m$是摩尔定容热容,$\Delta T$是温度变化量。
步骤 2:计算$\Delta H$
对于理想气体,$\Delta H=\Delta U+\Delta (pV)$。在等容过程中,$\Delta (pV)=nR\Delta T$,其中$R$是理想气体常数。因此,$\Delta H=\Delta U+nR\Delta T$。对于双原子分子理想气体,${C}_{{V}_{2}m}=\dfrac {5}{2}R$,所以$\Delta H=n{C}_{{V}_{2}m}\Delta T+nR\Delta T=n(\dfrac {5}{2}R+R)\Delta T=\dfrac {7}{2}nR\Delta T$。
步骤 3:代入数值计算
对于1 mol的氢气,$n=1$,$\Delta T=1K$,$R=8.314 J/(mol\cdot K)$,所以$\Delta H=\dfrac {7}{2}\times 1\times 8.314\times 1\approx 29.1J$。