题目
某双原子理想气体1mol 从始态350K,200 kPa经过如下四个不同过程达到各自的平衡态,求各过程的功W。(1)恒温可逆膨胀到50 kPa;(2)恒温反抗50 kPa恒外压不可逆膨胀;(3)绝热可逆膨胀到50kPA;(4)绝热反抗50 kPa恒外压不可逆膨胀。
某双原子理想气体1mol 从始态350K,200 kPa经过如下四个不同过程达到各自的平衡态,求各过程的功W。
(1)恒温可逆膨胀到50 kPa;
(2)恒温反抗50 kPa恒外压不可逆膨胀;
(3)绝热可逆膨胀到50kPA;
(4)绝热反抗50 kPa恒外压不可逆膨胀。
题目解答
答案
解:(1)恒温可逆膨胀到50 kPa:
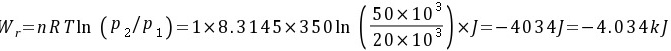
(2)恒温反抗50 kPa恒外压不可逆膨胀:
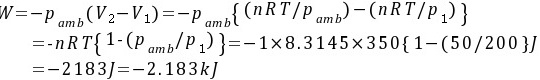
(3)绝热可逆膨胀到50kPa: 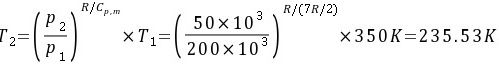
绝热,Q=0,
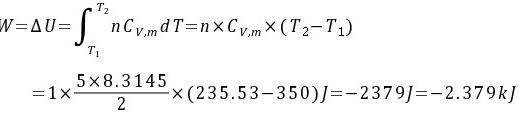
(4)绝热反抗50 kPa恒外压不可逆膨胀
绝热,Q=0, 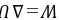
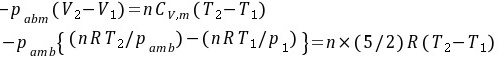
上式两边消去nR并代入有关数据得
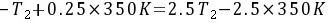
3.5T2=2.75×350K 故 T2=275K
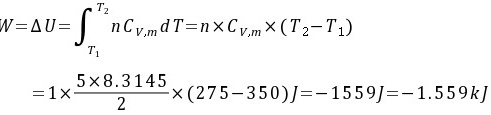
解析
步骤 1:恒温可逆膨胀到50 kPa
对于理想气体,恒温可逆过程的功可以通过公式 $W = -nRT \ln \left(\frac{P_1}{P_2}\right)$ 计算,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T$ 是温度,$P_1$ 和 $P_2$ 分别是初始和最终压力。
步骤 2:恒温反抗50 kPa恒外压不可逆膨胀
对于恒温反抗恒定外压的不可逆膨胀,功可以通过公式 $W = -P_{\text{外}} \Delta V$ 计算,其中 $P_{\text{外}}$ 是恒定外压,$\Delta V$ 是体积变化。
步骤 3:绝热可逆膨胀到50kPa
对于绝热可逆过程,功可以通过公式 $W = \Delta U = nC_V \Delta T$ 计算,其中 $C_V$ 是定容摩尔热容,$\Delta T$ 是温度变化。对于双原子理想气体,$C_V = \frac{5}{2}R$。
步骤 4:绝热反抗50 kPa恒外压不可逆膨胀
对于绝热反抗恒定外压的不可逆膨胀,功可以通过公式 $W = -P_{\text{外}} \Delta V$ 计算,其中 $P_{\text{外}}$ 是恒定外压,$\Delta V$ 是体积变化。同时,由于绝热过程,$Q = 0$,所以 $\Delta U = W$。
对于理想气体,恒温可逆过程的功可以通过公式 $W = -nRT \ln \left(\frac{P_1}{P_2}\right)$ 计算,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T$ 是温度,$P_1$ 和 $P_2$ 分别是初始和最终压力。
步骤 2:恒温反抗50 kPa恒外压不可逆膨胀
对于恒温反抗恒定外压的不可逆膨胀,功可以通过公式 $W = -P_{\text{外}} \Delta V$ 计算,其中 $P_{\text{外}}$ 是恒定外压,$\Delta V$ 是体积变化。
步骤 3:绝热可逆膨胀到50kPa
对于绝热可逆过程,功可以通过公式 $W = \Delta U = nC_V \Delta T$ 计算,其中 $C_V$ 是定容摩尔热容,$\Delta T$ 是温度变化。对于双原子理想气体,$C_V = \frac{5}{2}R$。
步骤 4:绝热反抗50 kPa恒外压不可逆膨胀
对于绝热反抗恒定外压的不可逆膨胀,功可以通过公式 $W = -P_{\text{外}} \Delta V$ 计算,其中 $P_{\text{外}}$ 是恒定外压,$\Delta V$ 是体积变化。同时,由于绝热过程,$Q = 0$,所以 $\Delta U = W$。