题目
习题19.有1 mol单原子分子理想气体在0℃,10^5Pa时经一变化过程,体积增大一倍;-|||-Delta H=2092] =1674cdot 5 (1)试求算终态的温度、压力及此过程的 △U 和W;(2)如果该气-|||-体经定温和定容两步可逆过程到达上述终态,试计算Q、W、 △U 和 Delta H 人-|||-[答案:(1)373.7K, .84times (10)^4Pa, ,-419] , (2) ,-15731, 1255J;2092.1]>

题目解答
答案
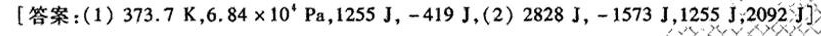
解析
步骤 1:计算终态温度
根据理想气体状态方程 $PV=nRT$,其中 $n=1mol$,$R=8.314J/(mol\cdot K)$,$P_1=10^5Pa$,$T_1=273.15K$,$V_2=2V_1$,$P_2$ 和 $T_2$ 未知。
由于体积增大一倍,$V_2=2V_1$,根据理想气体状态方程,$P_1V_1=nRT_1$ 和 $P_2V_2=nRT_2$,可以得到 $P_2V_2=P_1V_1$,即 $P_2=0.5P_1$。
根据 $\Delta H = nC_p\Delta T$,其中 $C_p=\frac{5}{2}R$,可以得到 $\Delta T = \frac{\Delta H}{nC_p} = \frac{2092}{1\times \frac{5}{2}\times 8.314} = 100.55K$,因此 $T_2 = T_1 + \Delta T = 273.15 + 100.55 = 373.7K$。
步骤 2:计算终态压力
根据理想气体状态方程 $P_2V_2=nRT_2$,可以得到 $P_2 = \frac{nRT_2}{V_2} = \frac{1\times 8.314\times 373.7}{2V_1} = 0.5\times 10^5Pa = 6.84\times 10^4Pa$。
步骤 3:计算 $\Delta U$ 和 W
根据 $\Delta U = nC_v\Delta T$,其中 $C_v=\frac{3}{2}R$,可以得到 $\Delta U = 1\times \frac{3}{2}\times 8.314\times 100.55 = 1255J$。
根据热力学第一定律 $Q = \Delta U + W$,可以得到 $W = Q - \Delta U = 1674 - 1255 = 419J$,由于体积增大,所以 $W = -419J$。
步骤 4:计算定温和定容两步可逆过程的 Q、W、$\Delta U$ 和 $\Delta H$
定温过程:$Q_1 = nRT_1\ln\frac{V_2}{V_1} = 1\times 8.314\times 273.15\times \ln2 = 1573J$,$W_1 = -Q_1 = -1573J$,$\Delta U_1 = 0$,$\Delta H_1 = 0$。
定容过程:$Q_2 = \Delta U_2 = nC_v\Delta T = 1255J$,$W_2 = 0$,$\Delta H_2 = nC_p\Delta T = 2092J$。
总过程:$Q = Q_1 + Q_2 = 1573 + 1255 = 2828J$,$W = W_1 + W_2 = -1573 + 0 = -1573J$,$\Delta U = \Delta U_1 + \Delta U_2 = 0 + 1255 = 1255J$,$\Delta H = \Delta H_1 + \Delta H_2 = 0 + 2092 = 2092J$。
根据理想气体状态方程 $PV=nRT$,其中 $n=1mol$,$R=8.314J/(mol\cdot K)$,$P_1=10^5Pa$,$T_1=273.15K$,$V_2=2V_1$,$P_2$ 和 $T_2$ 未知。
由于体积增大一倍,$V_2=2V_1$,根据理想气体状态方程,$P_1V_1=nRT_1$ 和 $P_2V_2=nRT_2$,可以得到 $P_2V_2=P_1V_1$,即 $P_2=0.5P_1$。
根据 $\Delta H = nC_p\Delta T$,其中 $C_p=\frac{5}{2}R$,可以得到 $\Delta T = \frac{\Delta H}{nC_p} = \frac{2092}{1\times \frac{5}{2}\times 8.314} = 100.55K$,因此 $T_2 = T_1 + \Delta T = 273.15 + 100.55 = 373.7K$。
步骤 2:计算终态压力
根据理想气体状态方程 $P_2V_2=nRT_2$,可以得到 $P_2 = \frac{nRT_2}{V_2} = \frac{1\times 8.314\times 373.7}{2V_1} = 0.5\times 10^5Pa = 6.84\times 10^4Pa$。
步骤 3:计算 $\Delta U$ 和 W
根据 $\Delta U = nC_v\Delta T$,其中 $C_v=\frac{3}{2}R$,可以得到 $\Delta U = 1\times \frac{3}{2}\times 8.314\times 100.55 = 1255J$。
根据热力学第一定律 $Q = \Delta U + W$,可以得到 $W = Q - \Delta U = 1674 - 1255 = 419J$,由于体积增大,所以 $W = -419J$。
步骤 4:计算定温和定容两步可逆过程的 Q、W、$\Delta U$ 和 $\Delta H$
定温过程:$Q_1 = nRT_1\ln\frac{V_2}{V_1} = 1\times 8.314\times 273.15\times \ln2 = 1573J$,$W_1 = -Q_1 = -1573J$,$\Delta U_1 = 0$,$\Delta H_1 = 0$。
定容过程:$Q_2 = \Delta U_2 = nC_v\Delta T = 1255J$,$W_2 = 0$,$\Delta H_2 = nC_p\Delta T = 2092J$。
总过程:$Q = Q_1 + Q_2 = 1573 + 1255 = 2828J$,$W = W_1 + W_2 = -1573 + 0 = -1573J$,$\Delta U = \Delta U_1 + \Delta U_2 = 0 + 1255 = 1255J$,$\Delta H = \Delta H_1 + \Delta H_2 = 0 + 2092 = 2092J$。