题目
5.8 写出下列轨道的符号:-|||-(1) n=4 ,l=0;-|||-(2) n=3 =1 ;-|||-(3) n=2 ,l=1;-|||-(4) n=5 ,l=3
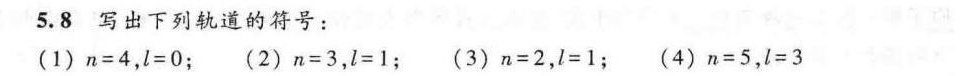
题目解答
答案
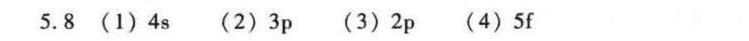
解析
本题考查原子轨道符号的书写,需要根据主量子数$n$和角量子数$l$确定轨道类型。解题核心在于:
- 主量子数$n$决定电子层,直接作为轨道符号的数字部分;
- 角量子数$l$决定轨道形状,对应关系为:$l=0$对应$s$,$l=1$对应$p$,$l=2$对应$d$,$l=3$对应$f$;
- 将$n$和对应的字母组合即可得到轨道符号。
第(1)题
- 主量子数$n=4$,对应第4电子层;
- 角量子数$l=0$,对应$s$轨道;
- 组合得4s轨道。
第(2)题
- 主量子数$n=3$,对应第3电子层;
- 角量子数$l=1$,对应$p$轨道;
- 组合得3p轨道。
第(3)题
- 主量子数$n=2$,对应第2电子层;
- 角量子数$l=1$,对应$p$轨道;
- 组合得2p轨道。
第(4)题
- 主量子数$n=5$,对应第5电子层;
- 角量子数$l=3$,对应$f$轨道;
- 组合得5f轨道。