题目
一容器贮有氧气,其压强p = 1.0atm,温度为t = 27℃.求:(1) 单位体积内的分子数;(2) 氧气的质量密度;(3) 氧分子的平均动能;(4) 氧分子的平均距离. (氧分子质量m=5.35×10-26kg)
一容器贮有氧气,其压强p = 1.0atm,温度为t = 27℃.求:
(1) 单位体积内的分子数;
(2) 氧气的质量密度;
(3) 氧分子的平均动能;
(4) 氧分子的平均距离. (氧分子质量m=5.35×10-26kg)
题目解答
答案
解: (1) n=p/(kT)=2.45×1025m-3
(2) =mn=mp/(kT)=1.31kg
(3) 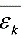 =5kT/2=1.04×10-20J
=5kT/2=1.04×10-20J
(4)设分子所占体积为球体,距离为d
1(m3)=n(4/3)(d/2)3= nd3/6
d=[6/(n)]1/3=[6kT/(p)]1/3=4.27×10-9m
或设分子所占体积为正方体体,
距离为d,则1(m3)=nd3
d=(1/n)1/3
=(kT/p)1/3=3.44×10-9m
解析
步骤 1:计算单位体积内的分子数
根据理想气体状态方程,压强p、体积V、温度T和分子数N之间的关系为pV = NkT,其中k为玻尔兹曼常数。单位体积内的分子数n = N/V,因此n = p/(kT)。
步骤 2:计算氧气的质量密度
氧气的质量密度ρ = mn,其中m为氧分子的质量。
步骤 3:计算氧分子的平均动能
氧分子的平均动能为(3/2)kT。
步骤 4:计算氧分子的平均距离
假设氧分子均匀分布,每个分子占据一个立方体,立方体的边长为d。则d = (1/n)^(1/3)。
根据理想气体状态方程,压强p、体积V、温度T和分子数N之间的关系为pV = NkT,其中k为玻尔兹曼常数。单位体积内的分子数n = N/V,因此n = p/(kT)。
步骤 2:计算氧气的质量密度
氧气的质量密度ρ = mn,其中m为氧分子的质量。
步骤 3:计算氧分子的平均动能
氧分子的平均动能为(3/2)kT。
步骤 4:计算氧分子的平均距离
假设氧分子均匀分布,每个分子占据一个立方体,立方体的边长为d。则d = (1/n)^(1/3)。