题目
有1mol的CO2,作如图所示的循环过程,ca为等温过程其中_(1)=2.0times (10)^5Pa,_(1)=2.0times (10)^5Pa,_(1)=2.0times (10)^5Pa求(1)ab过程吸收的热量, (2)该循环过程内能的变化,(3)循环的效率。
有1mol的CO2,作如图所示的循环过程,ca为等温过程其中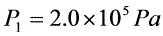 ,
,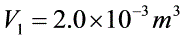 ,
,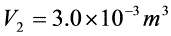 求(1)ab过程吸收的热量, (2)该循环过程内能的变化,(3)循环的效率。
求(1)ab过程吸收的热量, (2)该循环过程内能的变化,(3)循环的效率。
题目解答
答案
答案:(1)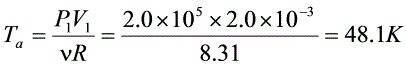
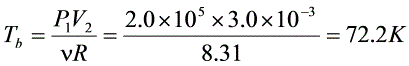
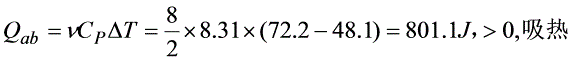
(2)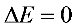
(3)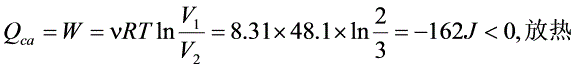
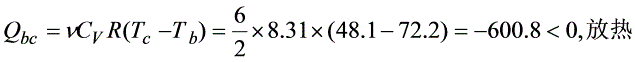
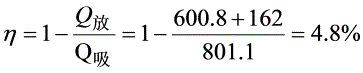
解析
题目考察知识
理想气体状态方程、热力学第一定律、内能变化、循环效率及等容、等压、等温等温过程的热量计算。
### 各问详细解析
(1) ab过程吸收的热量
- 确定过程性质:题目中未明确ab过程,但根据答案推测为等压过程(因用$Q_{ab}=VC_V\Delta T$公式,$C_V$为定容摩尔热容,$\Delta T=T_b-T_a$)。
- 计算温度:
由理想气体状态方程$PV=\mu RT$,\mu=1mol$,得$T=\frac{PV}{R}$:- $T_a=\frac{P_1V_1}{R}=\frac{2.0\times10^5Pa\times2.0\times10^{-3}m^3}{8.31J/(mol\cdot K)}\approx48.1K$
- $T_b=\frac{P_1V_2}{R}=\frac{2.0\times10^5Pa\times3.0\times10^{-3}m^3}{8.31J/(mol\cdot K)}\approx72.2K$
- 热量计算:等压过程热量$Q_{ab}=\mu C_p\Delta T$(C_p=C_V+R,单原子气体C_V=\frac{3}{2}R,C_p=\frac{5}{2}R)$:
$Q_{ab}=\frac{5}{2}\times8.31J/(mol\cdot K)\times(7{ {72.2K-48.1K)=801.1J>0$(吸热)。
(2) 循环过程内能的变化
- 循环过程特征:内能是状态函数,循环后回到初始状态,故$\Delta U=0$。
(3) 循环的效率
- 效率公式:$\eta=1-\frac{Q_{放}}{Q_{吸}}$,需确定吸热和放热:
- 吸热过程:仅ab过程吸热$Q_{吸}=801.1J$
- 放热过程:
- ca为等温过程($T_a$),热量$Q_{ca}=\mu RT_a\ln\frac{V_1V_2=8.31\times48.1\times\ln\frac{2}{3}\approx-162.1J$(放热,取绝对值162.1J)
- bc为等容过程($V_2$),热量热量$Q_{bc}=\mu C_V(T_a-T_b)=\frac{3}{2}\times8.31\times(48.1-72.2)\approx-600.8J$(放热,取绝对值600.8J)
- 总放热:$Q_{放}=162.1J+600.8J=762.9J$
- 效率:$\eta=1-\frac{762.9}{801.1}\approx4.8\%$