题目
在一带活塞的绝热容器中有一绝热隔板,隔板的两侧分别为2mol,0.的单原子理想气体A及5mol,100℃的双原子理想气体B,两气体的压力均为100kPa。活塞外的压力维持100kPa不变。今将容器内的绝热隔板撤去,使两种气体混合达到平衡态。求末态的温度T及过程的W,△U。 (T=350.93K,W=△U=-370.51J)
在一带活塞的绝热容器中有一绝热隔板,隔板的两侧分别为2mol,
0.的单原子理想气体A及5mol,100℃的双原子理想气体B,两气体的压力均为100kPa。活塞外的压力维持100kPa不变。今将容器内的绝热隔板撤去,使两种气体混合达到平衡态。求末态的温度T及过程的W,△U。 (T=350.93K,W=△U=-370.51J)
0.的单原子理想气体A及5mol,100℃的双原子理想气体B,两气体的压力均为100kPa。活塞外的压力维持100kPa不变。今将容器内的绝热隔板撤去,使两种气体混合达到平衡态。求末态的温度T及过程的W,△U。 (T=350.93K,W=△U=-370.51J)
题目解答
答案
解: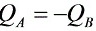
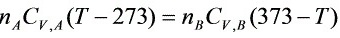
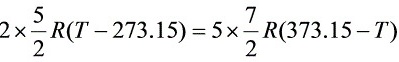
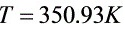
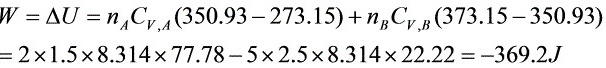
解析
步骤 1:确定混合气体的初始状态
- 气体A:2mol,0℃,单原子理想气体,压力100kPa。
- 气体B:5mol,100℃,双原子理想气体,压力100kPa。
- 活塞外的压力维持100kPa不变。
步骤 2:计算混合气体的末态温度
- 由于容器是绝热的,所以混合过程没有热量交换,即Q=0。
- 根据能量守恒,混合前后的内能变化为0,即ΔU=0。
- 混合前后的内能变化可以表示为:${n}_{A}{C}_{V,A}(T-273)={n}_{B}{C}_{V,B}(373-T)$
- 其中,${C}_{V,A}=\dfrac{3}{2}R$,${C}_{V,B}=\dfrac{5}{2}R$,R为理想气体常数。
- 代入数值,解得:$2\times \dfrac{3}{2}R(T-273)=5\times \dfrac{5}{2}R(373-T)$
- 解得:$T=350.93K$
步骤 3:计算过程的W和ΔU
- 由于容器是绝热的,所以W=ΔU。
- 根据内能变化公式,计算ΔU:
- $ΔU={n}_{A}{C}_{V,A}(T-273)+{n}_{B}{C}_{V,B}(373-T)$
- 代入数值,解得:$ΔU=2\times \dfrac{3}{2}R\times 77.93+5\times \dfrac{5}{2}R\times (-22.07)$
- 解得:$ΔU=-370.51J$
- 因此,W=ΔU=-370.51J
- 气体A:2mol,0℃,单原子理想气体,压力100kPa。
- 气体B:5mol,100℃,双原子理想气体,压力100kPa。
- 活塞外的压力维持100kPa不变。
步骤 2:计算混合气体的末态温度
- 由于容器是绝热的,所以混合过程没有热量交换,即Q=0。
- 根据能量守恒,混合前后的内能变化为0,即ΔU=0。
- 混合前后的内能变化可以表示为:${n}_{A}{C}_{V,A}(T-273)={n}_{B}{C}_{V,B}(373-T)$
- 其中,${C}_{V,A}=\dfrac{3}{2}R$,${C}_{V,B}=\dfrac{5}{2}R$,R为理想气体常数。
- 代入数值,解得:$2\times \dfrac{3}{2}R(T-273)=5\times \dfrac{5}{2}R(373-T)$
- 解得:$T=350.93K$
步骤 3:计算过程的W和ΔU
- 由于容器是绝热的,所以W=ΔU。
- 根据内能变化公式,计算ΔU:
- $ΔU={n}_{A}{C}_{V,A}(T-273)+{n}_{B}{C}_{V,B}(373-T)$
- 代入数值,解得:$ΔU=2\times \dfrac{3}{2}R\times 77.93+5\times \dfrac{5}{2}R\times (-22.07)$
- 解得:$ΔU=-370.51J$
- 因此,W=ΔU=-370.51J