题目
(10分)氢原子处于基态时,原子的能量为E1=-13.6 eV,当处于n=3的激发态时,能量为E3=-1.51 eV,普朗克常量h=6.63×10-34 J·s,求:(1)当氢原子从n=3的激发态跃迁到n=1的基态时,向外辐射的光子的波长是多少?(2)若要使处于基态的氢原子电离,至少要用多大频率的电磁波照射原子?(3)若有大量的氢原子处于n=3的激发态,则在跃迁过程中可能释放出几种频率的光子?其中最长波长是多少?解析:(1)根据能级之间能量差公式:ΔE=En-Em得ΔE13=E3-E1=-1.51 eV-(-13.6 eV)=12.09 eV(2分)光子的能量与波长之间的关系ΔE=hc-|||-λ(1分)所以从n=3激发态跃迁到n=1基态时发射光的波长λ=hc-|||-λ=hc-|||-λ m=1.03×10-7 m.(1分)(2)要使处于基态的氢原子电离,照射光光子的能量应能使电子从第1能级跃迁到无限远处,最小频率的电磁波的光子能量ε=hν=0-E1, (2分)解得,ν=hc-|||-λ=hc-|||-λ H =3.3×1015 H .(1分)(3)当大量氢原子处于n=3能级时,可释放出的光子频率种类为N=hc-|||-λ=3(种)(1分)据玻尔理论在这3种频率光子中,当氢原子从n=3能级向n=2能级跃迁时辐射的光子波长最长.依据En=hc-|||-λE1,知E2=hc-|||-λ×(-13.6)eV=-3.4 eV,因此hc-|||-λ=E3-E2(1分)λ′=hc-|||-λ=hc-|||-λ m=6.58×10-7 m.(1分).
(10分)氢原子处于基态时,原子的能量为E1=-13.6 eV,当处于n=3的激发态时,能量为E3=-1.51 eV,普朗克常量h=6.63×10-34 J·s,求:
(1)当氢原子从n=3的激发态跃迁到n=1的基态时,向外辐射的光子的波长是多少?
(2)若要使处于基态的氢原子电离,至少要用多大频率的电磁波照射原子?
(3)若有大量的氢原子处于n=3的激发态,则在跃迁过程中可能释放出几种频率的光子?其中最长波长是多少?
解析:(1)根据能级之间能量差公式:
ΔE=En-Em得
ΔE13=E3-E1=-1.51 eV-(-13.6 eV)=12.09 eV(2分)
光子的能量与波长之间的关系
ΔE= (1分)
(1分)
所以从n=3激发态跃迁到n=1基态时发射光的波长
λ=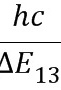 =
=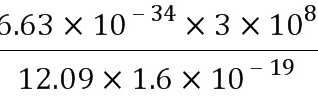 m=1.03×10-7 m.(1分)
m=1.03×10-7 m.(1分)
(2)要使处于基态的氢原子电离,照射光光子的能量应能使电子从第1能级跃迁到无限远处,最小频率的电磁波的光子能量ε=hν=0-E1, (2分)
解得,
ν=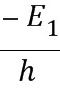 =
=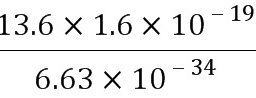 H =3.3×1015 H .(1分)
H =3.3×1015 H .(1分)
(3)当大量氢原子处于n=3能级时,可释放出的光子频率种类为N=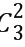 =3(种)(1分)
=3(种)(1分)
据玻尔理论在这3种频率光子中,当氢原子从n=3能级向n=2能级跃迁时辐射的光子波长最长.
依据En=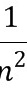 E1,
E1,
知E2= ×(-13.6)eV=-3.4 eV,
×(-13.6)eV=-3.4 eV,
因此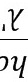 =E3-E2(1分)
=E3-E2(1分)
λ′=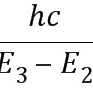 =
=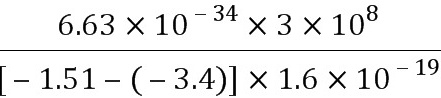 m=6.58×10-7 m.(1分)
m=6.58×10-7 m.(1分)
题目解答
答案
答案:(1)1.03×107、 m (2)3.3×1015 H
(3)3种 6.58×107、 m
.解析
步骤 1:计算从n=3激发态跃迁到n=1基态时发射光子的能量
根据能级之间能量差公式:
ΔE=En-Em得
ΔE13=E3-E1=-1.51 eV-(-13.6 eV)=12.09 eV
步骤 2:计算光子的波长
光子的能量与波长之间的关系
ΔE=v ou
所以从n=3激发态跃迁到n=1基态时发射光的波长
λ=EI yu=$6.63\times {10}^{-34}\times 3\times {10}^{8}$ m=1.03×10-7 m.
步骤 3:计算使氢原子电离所需的最小频率
要使处于基态的氢原子电离,照射光光子的能量应能使电子从第1能级跃迁到无限远处,最小频率的电磁波的光子能量ε=hν=0-E1,
ν=$-{E}_{1}$ h=$13.6\times 1.6\times {10}^{-19}$ H =3.3×1015 H .
步骤 4:计算从n=3能级跃迁时可能释放出的光子频率种类
当大量氢原子处于n=3能级时,可释放出的光子频率种类为N==3(种)
步骤 5:计算从n=3能级向n=2能级跃迁时辐射的光子波长
据玻尔理论在这3种频率光子中,当氢原子从n=3能级向n=2能级跃迁时辐射的光子波长最长.
依据En=1 n^2E1,
知E2=1 4×(-13.6)eV=-3.4 eV,
因此ho 入'=E3-E2
λ′=$\dfrac {hc}{{B}_{3}-{E}_{2}}$=$-1.51-(-3.4)] \times 1.6\times {10}^{-19}$ m=6.58×10-7 m.
根据能级之间能量差公式:
ΔE=En-Em得
ΔE13=E3-E1=-1.51 eV-(-13.6 eV)=12.09 eV
步骤 2:计算光子的波长
光子的能量与波长之间的关系
ΔE=v ou
所以从n=3激发态跃迁到n=1基态时发射光的波长
λ=EI yu=$6.63\times {10}^{-34}\times 3\times {10}^{8}$ m=1.03×10-7 m.
步骤 3:计算使氢原子电离所需的最小频率
要使处于基态的氢原子电离,照射光光子的能量应能使电子从第1能级跃迁到无限远处,最小频率的电磁波的光子能量ε=hν=0-E1,
ν=$-{E}_{1}$ h=$13.6\times 1.6\times {10}^{-19}$ H =3.3×1015 H .
步骤 4:计算从n=3能级跃迁时可能释放出的光子频率种类
当大量氢原子处于n=3能级时,可释放出的光子频率种类为N==3(种)
步骤 5:计算从n=3能级向n=2能级跃迁时辐射的光子波长
据玻尔理论在这3种频率光子中,当氢原子从n=3能级向n=2能级跃迁时辐射的光子波长最长.
依据En=1 n^2E1,
知E2=1 4×(-13.6)eV=-3.4 eV,
因此ho 入'=E3-E2
λ′=$\dfrac {hc}{{B}_{3}-{E}_{2}}$=$-1.51-(-3.4)] \times 1.6\times {10}^{-19}$ m=6.58×10-7 m.