题目
43.在容积为V的容器内,同时盛有质量为M1和质量为M2的两种单原子分子的理想-|||-气体,已知此混合气体处于平衡状态时它们的内能相等,且均为E。则混合气体压强 p=-|||-__ 两种分子的平均速率之比 (overline {{v)_(1)}/overline ({v)_(2)}= __ 。

题目解答
答案
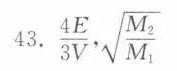
解析
考查要点:本题综合考查理想气体状态方程、内能公式及分子平均速率的计算,需结合混合气体的分压定律进行分析。
解题核心思路:
- 内能相等与温度关系:两种气体内能相等且温度相同(平衡状态),利用单原子分子内能公式 $E = \frac{3}{2}NkT$,得出两种气体分子数相等。
- 分压求和:根据道尔顿分压定律,总压强为两气体分压之和,结合理想气体状态方程 $pV = NkT$ 计算。
- 平均速率比:利用平均速率公式 $\overline{v} = \sqrt{\frac{8kT}{\pi m}}$,结合分子质量与总质量的关系推导。
破题关键点:
- 温度相同:混合气体平衡时温度相同。
- 分子数相等:内能相等且温度相同,分子数必然相等。
- 分子质量与总质量关系:单个分子质量 $m = \frac{M}{N}$,结合分子数相等推导速率比。
混合气体压强 $p$
- 内能公式:单原子分子内能 $E = \frac{3}{2}NkT$,两种气体内能均为 $E$,温度相同,故分子数相等,即 $N_1 = N_2 = N$。
- 分压计算:每种气体分压 $p_1 = \frac{NkT}{V}$,$p_2 = \frac{NkT}{V}$,总压强 $p = p_1 + p_2 = \frac{2NkT}{V}$。
- 代入内能关系:由 $E = \frac{3}{2}NkT$ 得 $NkT = \frac{2E}{3}$,代入总压强公式得:
$p = \frac{2 \cdot \frac{2E}{3}}{V} = \frac{4E}{3V}.$
平均速率比 $\frac{\overline{v}_1}{\overline{v}_2}$
- 平均速率公式:$\overline{v} = \sqrt{\frac{8kT}{\pi m}}$,温度相同,故 $\frac{\overline{v}_1}{\overline{v}_2} = \sqrt{\frac{m_2}{m_1}}$。
- 分子质量关系:单个分子质量 $m_1 = \frac{M_1}{N_1}$,$m_2 = \frac{M_2}{N_2}$,因 $N_1 = N_2$,故 $\frac{m_2}{m_1} = \frac{M_2}{M_1}$。
- 最终比值:
$\frac{\overline{v}_1}{\overline{v}_2} = \sqrt{\frac{M_2}{M_1}}.$