题目
气体的标准态为100 Pa的纯理想气体,则zoo在zoo标准状态下的密度为_______。A zooB zooC zooD zoo
气体的标准态为100 Pa的纯理想气体,则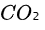 在
在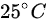 标准状态下的密度为_______。
标准状态下的密度为_______。
A 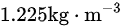
B 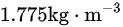
C 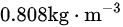
D 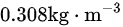
题目解答
答案
首先,将温度从摄氏度转换为开尔文:
绝对温度(T)= 25摄氏度 + 273.15 = 298.15K
然后,将压力从帕斯卡转换为标准大气压:
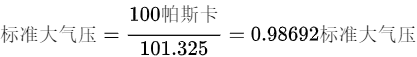
使用理想气体状态方程 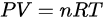 计算摩尔数(n):
计算摩尔数(n):
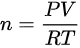
将已知的数值代入公式:
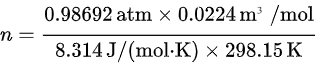
计算密度:
密度(ρ)可以通过摩尔质量(M)和摩尔数(n)计算,公式为:
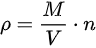
对于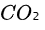 ,摩尔质量 M 为
,摩尔质量 M 为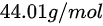 。我们需要将摩尔质量转化为千克/摩尔,所以
。我们需要将摩尔质量转化为千克/摩尔,所以 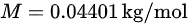 。
。
现在,我们可以将 n 和 M 代入密度公式:
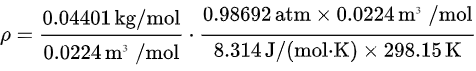
计算后,得出二氧化碳(CO₂)在标准状态下的密度为:
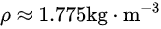
所以,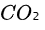 在标准状态下的密度约为1.775千克/立方米。所以答案为选项B
在标准状态下的密度约为1.775千克/立方米。所以答案为选项B 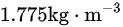 。
。
解析
步骤 1:温度转换
将温度从摄氏度转换为开尔文:绝对温度(T)= 25摄氏度 + 273.15 = 298.15K。
步骤 2:压力转换
将压力从帕斯卡转换为标准大气压:标准大气压 $=\dfrac {1001UNDUND}{101.325}=0.98692$ 标准大气压。
步骤 3:计算摩尔数
使用理想气体状态方程 Idu=Ad 计算摩尔数(n):$\dfrac {IH}{\Delta d}=u$。将已知的数值代入公式:$n=\dfrac {0.98692atm\times 0.0224{m}^{3}/mol}{8.314J/mol\cdot kJ\times 298.15K}$。
步骤 4:计算密度
密度(ρ)可以通过摩尔质量(M)和摩尔数(n)计算,公式为:$u\cdot \dfrac {A}{W}=d$。对于zoo,摩尔质量 M 为44.01g/mol。我们需要将摩尔质量转化为千克/摩尔,所以 M=0.04401kg/mol。现在,我们可以将 n 和 M 代入密度公式:$\rho =\dfrac {0.04401kg/mol}{0.0224{m}^{3}/mol}$ $0.98692at\times 0.0224{m}^{3}/mol$。计算后,得出二氧化碳(CO₂)在标准状态下的密度为:$\rho \approx 1.775kg\cdot {m}^{-3}$。
将温度从摄氏度转换为开尔文:绝对温度(T)= 25摄氏度 + 273.15 = 298.15K。
步骤 2:压力转换
将压力从帕斯卡转换为标准大气压:标准大气压 $=\dfrac {1001UNDUND}{101.325}=0.98692$ 标准大气压。
步骤 3:计算摩尔数
使用理想气体状态方程 Idu=Ad 计算摩尔数(n):$\dfrac {IH}{\Delta d}=u$。将已知的数值代入公式:$n=\dfrac {0.98692atm\times 0.0224{m}^{3}/mol}{8.314J/mol\cdot kJ\times 298.15K}$。
步骤 4:计算密度
密度(ρ)可以通过摩尔质量(M)和摩尔数(n)计算,公式为:$u\cdot \dfrac {A}{W}=d$。对于zoo,摩尔质量 M 为44.01g/mol。我们需要将摩尔质量转化为千克/摩尔,所以 M=0.04401kg/mol。现在,我们可以将 n 和 M 代入密度公式:$\rho =\dfrac {0.04401kg/mol}{0.0224{m}^{3}/mol}$ $0.98692at\times 0.0224{m}^{3}/mol$。计算后,得出二氧化碳(CO₂)在标准状态下的密度为:$\rho \approx 1.775kg\cdot {m}^{-3}$。