题目
1 mol的双原子分子理想气体,在1 atm的恒定压强下,从O。0加热到O。0,则气体的内能改变了_J .(普适气体常量O。0)
1 mol的双原子分子理想气体,在1 atm的恒定压强下,从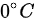 加热到
加热到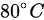 ,则气体的内能改变了_J .
,则气体的内能改变了_J .
(普适气体常量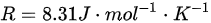 )
)
题目解答
答案
答案:1662 J
解析:
首先,对于理想气体,内能的变化只与温度的变化有关,其内能的变化量可以通过以下公式计算:
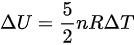
已知 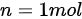 ,
,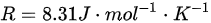 ,初始温度
,初始温度 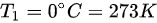 ,最终温度
,最终温度 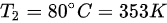 ,则温度变化量
,则温度变化量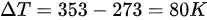 。
。
所以内能的变化量为:
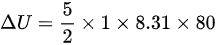
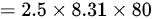
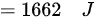
综上所述,气体的内能改变了 1662 J 。
解析
步骤 1:确定理想气体的内能变化公式
对于理想气体,内能的变化只与温度的变化有关,其内能的变化量可以通过以下公式计算:
$\Delta U=\dfrac {5}{2}nR\Delta T$
其中,$\Delta U$ 表示内能的变化量,$n$ 表示物质的量,$R$ 表示普适气体常量,$\Delta T$ 表示温度的变化量。
步骤 2:代入已知条件
已知 n=1mol,$R=8.31J\cdot {mol}^{-1}\cdot {K}^{-1}$,初始温度 ${T}_{1}={0}^{\circ }C=273K$ ,最终温度 ${T}_{2}={80}^{\circ }C=353K$ ,则温度变化量$\Delta T=353-273=80K$。
步骤 3:计算内能变化量
将已知条件代入内能变化公式中,计算内能变化量:
$\Delta U=\dfrac {5}{2}\times 1\times 8.31\times 80$
$=2.5\times 8.31\times 80$
$=1662\quad J$
对于理想气体,内能的变化只与温度的变化有关,其内能的变化量可以通过以下公式计算:
$\Delta U=\dfrac {5}{2}nR\Delta T$
其中,$\Delta U$ 表示内能的变化量,$n$ 表示物质的量,$R$ 表示普适气体常量,$\Delta T$ 表示温度的变化量。
步骤 2:代入已知条件
已知 n=1mol,$R=8.31J\cdot {mol}^{-1}\cdot {K}^{-1}$,初始温度 ${T}_{1}={0}^{\circ }C=273K$ ,最终温度 ${T}_{2}={80}^{\circ }C=353K$ ,则温度变化量$\Delta T=353-273=80K$。
步骤 3:计算内能变化量
将已知条件代入内能变化公式中,计算内能变化量:
$\Delta U=\dfrac {5}{2}\times 1\times 8.31\times 80$
$=2.5\times 8.31\times 80$
$=1662\quad J$