题目
已知用光照的办法将氢原子基态的电子电离,可用的最长波长是913的紫外光,那么氢原子从各受激态跃迁至基态的赖曼系光谱的波长可表示为: [ ]A.B.C.D.
已知用光照的办法将氢原子基态的电子电离,可用的最长波长是913 的紫外
的紫外
 的紫外
的紫外光,那么氢原子从各受激态跃迁至基态的赖曼系光谱的波长可表示为: [ ]
- A.
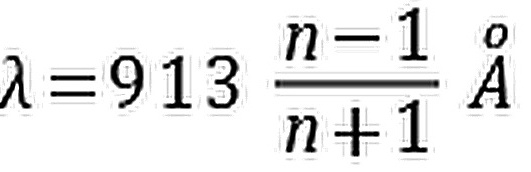
- B.
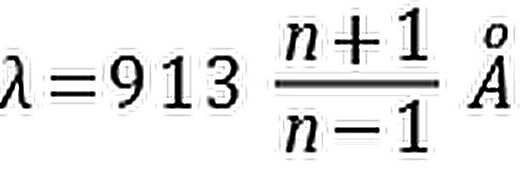
- C.
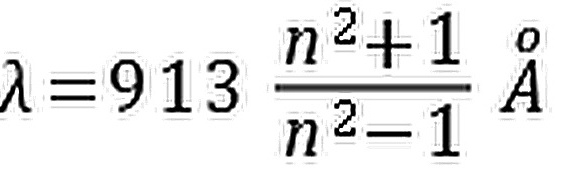
- D.
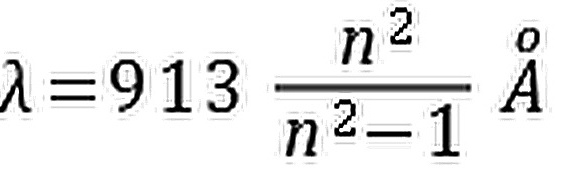
题目解答
答案
D. $\lambda =913\dfrac {{n}^{2}}{{n}^{2}-1}A$
解析
步骤 1:理解氢原子的能级跃迁
氢原子的能级跃迁遵循玻尔模型,其中电子从一个能级跃迁到另一个能级时会发射或吸收特定波长的光。当电子从高能级跃迁到低能级时,会发射光子,其能量等于两个能级之间的能量差。
步骤 2:确定基态和电离能级
氢原子的基态能量为$E_1$,而电离能级的能量为$E_{\infty} = 0$。当电子从基态跃迁到电离能级时,需要吸收的能量等于基态的能量$E_1$。根据题目,这个能量对应于波长为913埃的紫外光,即$E_1 = h c / \lambda_{ion}$,其中$h$是普朗克常数,$c$是光速,$\lambda_{ion} = 913$埃。
步骤 3:计算赖曼系光谱的波长
赖曼系光谱是氢原子从高能级$n$跃迁到基态时发射的光谱。根据玻尔模型,能级之间的能量差为$E_n - E_1$,其中$E_n = -E_1 / n^2$。因此,发射光子的能量为$E_n - E_1 = E_1 (1 - 1/n^2)$。根据光子能量和波长的关系$E = h c / \lambda$,可以得到赖曼系光谱的波长为$\lambda = h c / (E_1 (1 - 1/n^2))$。将$E_1 = h c / \lambda_{ion}$代入,得到$\lambda = \lambda_{ion} / (1 - 1/n^2) = \lambda_{ion} n^2 / (n^2 - 1)$。
氢原子的能级跃迁遵循玻尔模型,其中电子从一个能级跃迁到另一个能级时会发射或吸收特定波长的光。当电子从高能级跃迁到低能级时,会发射光子,其能量等于两个能级之间的能量差。
步骤 2:确定基态和电离能级
氢原子的基态能量为$E_1$,而电离能级的能量为$E_{\infty} = 0$。当电子从基态跃迁到电离能级时,需要吸收的能量等于基态的能量$E_1$。根据题目,这个能量对应于波长为913埃的紫外光,即$E_1 = h c / \lambda_{ion}$,其中$h$是普朗克常数,$c$是光速,$\lambda_{ion} = 913$埃。
步骤 3:计算赖曼系光谱的波长
赖曼系光谱是氢原子从高能级$n$跃迁到基态时发射的光谱。根据玻尔模型,能级之间的能量差为$E_n - E_1$,其中$E_n = -E_1 / n^2$。因此,发射光子的能量为$E_n - E_1 = E_1 (1 - 1/n^2)$。根据光子能量和波长的关系$E = h c / \lambda$,可以得到赖曼系光谱的波长为$\lambda = h c / (E_1 (1 - 1/n^2))$。将$E_1 = h c / \lambda_{ion}$代入,得到$\lambda = \lambda_{ion} / (1 - 1/n^2) = \lambda_{ion} n^2 / (n^2 - 1)$。