题目
粗略地估计一杯水中的正电荷有多少库仑。(水杯的体积是200ml)
粗略地估计一杯水中的正电荷有多少库仑。(水杯的体积是200ml)
题目解答
答案
一杯水约为200g,水的摩尔质量为18g/mol,则一杯水的物质的量为: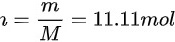 ;
;
故水分子数有: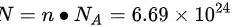 个。
个。
一个水分子中含有2个氢原子,一个氧原子,因此一个水分子带有10个正电,而每个正电荷的电荷量为: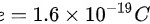 ,因此一杯水中正电荷所带电荷量为:
,因此一杯水中正电荷所带电荷量为: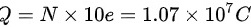
解析
步骤 1:计算水的物质的量
水的摩尔质量为18g/mol,一杯水的质量为200g,因此物质的量为:$n = \dfrac{m}{M} = \dfrac{200g}{18g/mol} = 11.11mol$。
步骤 2:计算水分子数
根据阿伏伽德罗常数$N_A = 6.022 \times 10^{23} mol^{-1}$,一杯水的水分子数为:$N = n \cdot N_A = 11.11mol \times 6.022 \times 10^{23} mol^{-1} = 6.69 \times 10^{24}$个。
步骤 3:计算正电荷的电荷量
一个水分子由2个氢原子和1个氧原子组成,每个氢原子带1个正电荷,每个氧原子带8个正电荷,因此一个水分子带有10个正电荷。每个正电荷的电荷量为$1.6 \times 10^{-19}C$,因此一杯水中正电荷所带电荷量为:$Q = N \times 10e = 6.69 \times 10^{24} \times 10 \times 1.6 \times 10^{-19}C = 1.07 \times 10^{7}C$。
水的摩尔质量为18g/mol,一杯水的质量为200g,因此物质的量为:$n = \dfrac{m}{M} = \dfrac{200g}{18g/mol} = 11.11mol$。
步骤 2:计算水分子数
根据阿伏伽德罗常数$N_A = 6.022 \times 10^{23} mol^{-1}$,一杯水的水分子数为:$N = n \cdot N_A = 11.11mol \times 6.022 \times 10^{23} mol^{-1} = 6.69 \times 10^{24}$个。
步骤 3:计算正电荷的电荷量
一个水分子由2个氢原子和1个氧原子组成,每个氢原子带1个正电荷,每个氧原子带8个正电荷,因此一个水分子带有10个正电荷。每个正电荷的电荷量为$1.6 \times 10^{-19}C$,因此一杯水中正电荷所带电荷量为:$Q = N \times 10e = 6.69 \times 10^{24} \times 10 \times 1.6 \times 10^{-19}C = 1.07 \times 10^{7}C$。