题目
8-6 将1kg氦气和Mkg氢气混合,平衡后混合气体的内能是 .45times (10)^6J, 氦分子平-|||-均动能是 times (10)^-21] , 求氢气质量M。-|||-(玻耳兹曼常量 =1.38times (10)^-23Jcdot (K)^-1, 普适气体常量 =8.31Jcdot mo(l)^-1cdot (K)^-1

题目解答
答案
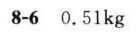
解析
步骤 1:计算氦气的摩尔数
氦气的摩尔质量为 $4g/mol$,所以1kg氦气的摩尔数为:
$$
n_{He} = \frac{1000g}{4g/mol} = 250mol
$$
步骤 2:计算氦气的内能
氦气是单原子分子,其内能为:
$$
U_{He} = \frac{3}{2}n_{He}RT
$$
其中,$R$ 是普适气体常量,$T$ 是温度。氦分子的平均动能为 $6\times {10}^{-21}J$,根据 $E_{k} = \frac{3}{2}kT$,可以计算出温度 $T$:
$$
T = \frac{2E_{k}}{3k} = \frac{2\times 6\times {10}^{-21}J}{3\times 1.38\times {10}^{-23}J\cdot {K}^{-1}} = 290K
$$
将 $n_{He}$ 和 $T$ 代入氦气内能公式,得到:
$$
U_{He} = \frac{3}{2}\times 250mol\times 8.31J\cdot {mol}^{-1}\cdot {K}^{-1}\times 290K = 9.1\times {10}^{5}J
$$
步骤 3:计算氢气的内能
混合气体的总内能为 $2.45\times {10}^{6}J$,所以氢气的内能为:
$$
U_{H_{2}} = 2.45\times {10}^{6}J - 9.1\times {10}^{5}J = 1.54\times {10}^{6}J
$$
氢气是双原子分子,其内能为:
$$
U_{H_{2}} = \frac{5}{2}n_{H_{2}}RT
$$
将 $U_{H_{2}}$ 和 $T$ 代入氢气内能公式,得到:
$$
1.54\times {10}^{6}J = \frac{5}{2}n_{H_{2}}\times 8.31J\cdot {mol}^{-1}\cdot {K}^{-1}\times 290K
$$
解得:
$$
n_{H_{2}} = \frac{1.54\times {10}^{6}J\times 2}{5\times 8.31J\cdot {mol}^{-1}\cdot {K}^{-1}\times 290K} = 255mol
$$
步骤 4:计算氢气的质量
氢气的摩尔质量为 $2g/mol$,所以氢气的质量为:
$$
M = 255mol\times 2g/mol = 510g = 0.51kg
$$
氦气的摩尔质量为 $4g/mol$,所以1kg氦气的摩尔数为:
$$
n_{He} = \frac{1000g}{4g/mol} = 250mol
$$
步骤 2:计算氦气的内能
氦气是单原子分子,其内能为:
$$
U_{He} = \frac{3}{2}n_{He}RT
$$
其中,$R$ 是普适气体常量,$T$ 是温度。氦分子的平均动能为 $6\times {10}^{-21}J$,根据 $E_{k} = \frac{3}{2}kT$,可以计算出温度 $T$:
$$
T = \frac{2E_{k}}{3k} = \frac{2\times 6\times {10}^{-21}J}{3\times 1.38\times {10}^{-23}J\cdot {K}^{-1}} = 290K
$$
将 $n_{He}$ 和 $T$ 代入氦气内能公式,得到:
$$
U_{He} = \frac{3}{2}\times 250mol\times 8.31J\cdot {mol}^{-1}\cdot {K}^{-1}\times 290K = 9.1\times {10}^{5}J
$$
步骤 3:计算氢气的内能
混合气体的总内能为 $2.45\times {10}^{6}J$,所以氢气的内能为:
$$
U_{H_{2}} = 2.45\times {10}^{6}J - 9.1\times {10}^{5}J = 1.54\times {10}^{6}J
$$
氢气是双原子分子,其内能为:
$$
U_{H_{2}} = \frac{5}{2}n_{H_{2}}RT
$$
将 $U_{H_{2}}$ 和 $T$ 代入氢气内能公式,得到:
$$
1.54\times {10}^{6}J = \frac{5}{2}n_{H_{2}}\times 8.31J\cdot {mol}^{-1}\cdot {K}^{-1}\times 290K
$$
解得:
$$
n_{H_{2}} = \frac{1.54\times {10}^{6}J\times 2}{5\times 8.31J\cdot {mol}^{-1}\cdot {K}^{-1}\times 290K} = 255mol
$$
步骤 4:计算氢气的质量
氢气的摩尔质量为 $2g/mol$,所以氢气的质量为:
$$
M = 255mol\times 2g/mol = 510g = 0.51kg
$$