题目
1-10 两个相连的容器,一个体积为1dm^3,内装氮气,压力为 https:/img.zuoyebang.cc/zyb_ecbc0fa750a46d9d6d483dc2d8df4887.jpg.6times (10)^5Ncdot (m)^-2; 另一个体积为4dm^3,内-|||-装氧气,压力为 .6times (10)^5Ncdot (m)^-2 当打开连通旋塞后,两种气体充分均匀地混合。试计算:(1)混合气体的-|||-总压;(2)每种气体的分压和摩尔分数。

题目解答
答案
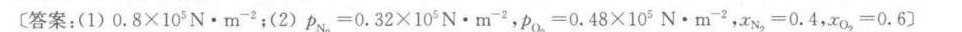
解析
步骤 1:计算氮气的摩尔数
根据理想气体状态方程 $PV=nRT$,可以计算氮气的摩尔数 $n_{N_2}$。其中,$P_{N_2}=1.6\times {10}^{5}N\cdot {m}^{-2}$,$V_{N_2}=1dm^3=1\times {10}^{-3}m^3$,$R=8.314J\cdot mol^{-1}\cdot K^{-1}$,假设温度为标准温度 $T=273K$。
步骤 2:计算氧气的摩尔数
同样地,根据理想气体状态方程 $PV=nRT$,可以计算氧气的摩尔数 $n_{O_2}$。其中,$P_{O_2}=0.6\times {10}^{5}N\cdot {m}^{-2}$,$V_{O_2}=4dm^3=4\times {10}^{-3}m^3$,$R=8.314J\cdot mol^{-1}\cdot K^{-1}$,假设温度为标准温度 $T=273K$。
步骤 3:计算混合气体的总压
根据道尔顿分压定律,混合气体的总压等于各组分气体的分压之和。即 $P_{total}=P_{N_2}+P_{O_2}$。
步骤 4:计算每种气体的分压和摩尔分数
根据道尔顿分压定律,每种气体的分压等于该气体的摩尔分数乘以总压。即 $P_{N_2}=x_{N_2}P_{total}$,$P_{O_2}=x_{O_2}P_{total}$。其中,$x_{N_2}=\frac{n_{N_2}}{n_{total}}$,$x_{O_2}=\frac{n_{O_2}}{n_{total}}$,$n_{total}=n_{N_2}+n_{O_2}$。
根据理想气体状态方程 $PV=nRT$,可以计算氮气的摩尔数 $n_{N_2}$。其中,$P_{N_2}=1.6\times {10}^{5}N\cdot {m}^{-2}$,$V_{N_2}=1dm^3=1\times {10}^{-3}m^3$,$R=8.314J\cdot mol^{-1}\cdot K^{-1}$,假设温度为标准温度 $T=273K$。
步骤 2:计算氧气的摩尔数
同样地,根据理想气体状态方程 $PV=nRT$,可以计算氧气的摩尔数 $n_{O_2}$。其中,$P_{O_2}=0.6\times {10}^{5}N\cdot {m}^{-2}$,$V_{O_2}=4dm^3=4\times {10}^{-3}m^3$,$R=8.314J\cdot mol^{-1}\cdot K^{-1}$,假设温度为标准温度 $T=273K$。
步骤 3:计算混合气体的总压
根据道尔顿分压定律,混合气体的总压等于各组分气体的分压之和。即 $P_{total}=P_{N_2}+P_{O_2}$。
步骤 4:计算每种气体的分压和摩尔分数
根据道尔顿分压定律,每种气体的分压等于该气体的摩尔分数乘以总压。即 $P_{N_2}=x_{N_2}P_{total}$,$P_{O_2}=x_{O_2}P_{total}$。其中,$x_{N_2}=\frac{n_{N_2}}{n_{total}}$,$x_{O_2}=\frac{n_{O_2}}{n_{total}}$,$n_{total}=n_{N_2}+n_{O_2}$。