题目
8.13一系统由如图所示的状态a沿abc到-|||-达c,吸收了350J的热量同时系统对外做功126J.-|||-求:(1)如经adc过程,系统对外做功42J,问系统-|||-吸热多少?(2)当系统由状态c沿曲线ac回到状-|||-态a时,外界对系统做功为84J,问系统是吸热还-|||-是放热,在这一过程中系统与外界之间传递的热量-|||-为多少?-|||-p-|||-b1 c-|||-a d-|||-v-|||-习题8.13图

题目解答
答案
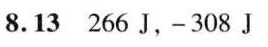
解析
考查要点:本题主要考查热力学第一定律的应用,涉及状态变化过程中的内能变化、热量和做功的关系。关键在于理解状态函数(内能)的性质,以及正确处理不同过程中功的符号。
解题核心思路:
- 内能是状态函数,因此沿不同路径从同一初态到同一末态,内能变化量ΔU相同。
- 对于每个过程,应用热力学第一定律 ΔU = Q + W(其中W为外界对系统做的功)。
- 注意区分系统对外做功与外界对系统做功的符号:系统对外做功时,W为负;外界对系统做功时,W为正。
破题关键点:
- 第(1)问:利用ΔU相同,结合已知过程的Q和W,求出adc过程的Q。
- 第(2)问:从c到a的ΔU为相反数,结合外界做功求Q,并判断吸/放热。
第(1)题
计算从a到c的ΔU
沿abc过程,已知系统吸收热量 Q₁ = 350 J,对外做功 W₁ = 126 J。根据热力学第一定律:
$\Delta U = Q + W_{\text{外}} \quad \text{(W外为外界对系统做的功)}$
由于系统对外做功,外界对系统的功为 W₁ = -126 J,因此:
$\Delta U = 350 + (-126) = 224 \, \text{J}$
计算adc过程的Q
从a到c的ΔU相同,即 ΔU = 224 J。adc过程中系统对外做功 W₂ = 42 J,外界对系统的功为 W₂ = -42 J。代入公式:
$\Delta U = Q + W \implies 224 = Q + (-42) \implies Q = 224 + 42 = 266 \, \text{J}$
第(2)题
计算从c到a的ΔU
从c到a的内能变化为 ΔU = -224 J(与a到c相反)。
计算热量Q
外界对系统做功 W = 84 J,代入热力学第一定律:
$\Delta U = Q + W \implies -224 = Q + 84 \implies Q = -224 - 84 = -308 \, \text{J}$
负号表示系统放出热量,传递的热量为 308 J。