题目
4.一瓶氢气和一瓶氧气温度相同。若氢气分子的平均平动动能为-|||-.21times (10)^-21J, 求:(1)氧气分子的平均平动动能和方均根速率;(2)氧气的-|||-温度。

题目解答
答案
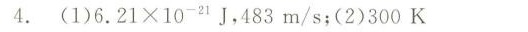
解析
关键知识点:
- 温度是分子平均平动动能的标志,温度相同的气体,分子平均平动动能相等,与气体种类无关。
- 方均根速率公式:$v_{\text{rms}} = \sqrt{\dfrac{3kT}{m}}$ 或等价形式 $v_{\text{rms}} = \sqrt{\dfrac{3RT}{M}}$($M$为摩尔质量)。
- 平均平动动能与温度关系:$\overline{E}_k = \dfrac{3}{2}kT$,可反推温度。
解题思路:
- (1) 利用温度相同,直接得出氧气分子的平均平动动能与氢气相同。
- (2) 通过平均平动动能计算温度,再代入方均根速率公式求解。
第(1)题
氧气分子的平均平动动能
温度相同,氢气和氧气的分子平均平动动能相等,因此:
$\overline{E}_k = 6.21 \times 10^{-21} \, \text{J}$
氧气的方均根速率
- 计算温度:
由 $\overline{E}_k = \dfrac{3}{2}kT$,得:
$T = \dfrac{2\overline{E}_k}{3k} = \dfrac{2 \times 6.21 \times 10^{-21}}{3 \times 1.38 \times 10^{-23}} \approx 300 \, \text{K}$ - 代入方均根速率公式:
氧气分子质量 $m = \dfrac{M}{N_A} = \dfrac{0.032 \, \text{kg/mol}}{6.022 \times 10^{23} \, \text{mol}^{-1}} \approx 5.314 \times 10^{-26} \, \text{kg}$,则:
$v_{\text{rms}} = \sqrt{\dfrac{3kT}{m}} = \sqrt{\dfrac{3 \times 1.38 \times 10^{-23} \times 300}{5.314 \times 10^{-26}}} \approx 483 \, \text{m/s}$
第(2)题
氧气的温度:
由第(1)题计算可知,温度为 $T = 300 \, \text{K}$。