题目
习题8 在25℃下,将50gN2做定温可逆压缩,从10^5Pa压缩到 times (10)^6Pa ,试计算此-|||-过程的功。如果被压缩了的气体反抗恒定外压10^5Pa做定温膨胀到原来的状态,问此 膨 胀-|||-过程的功又为若干?-|||-[答案: https:/img.zuoyebang.cc/zyb_63414a4942992d9239825a04f28eb364.jpg.33times (10)^4J -4.20times (10)^3J

题目解答
答案
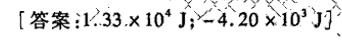
解析
步骤 1:计算初始状态的摩尔数
首先,计算氮气的摩尔数。氮气的摩尔质量为28g/mol,因此50g氮气的摩尔数为:
$$ n = \frac{50g}{28g/mol} = 1.7857mol $$
步骤 2:计算定温可逆压缩过程的功
定温可逆压缩过程的功可以用公式计算:
$$ W = -nRT\ln\left(\frac{P_2}{P_1}\right) $$
其中,$n$是摩尔数,$R$是理想气体常数(8.314 J/mol·K),$T$是温度(25℃=298.15K),$P_1$是初始压力($10^5Pa$),$P_2$是最终压力($2\times {10}^{6}Pa$)。
代入数值计算:
$$ W = -1.7857mol \times 8.314 J/mol·K \times 298.15K \times \ln\left(\frac{2\times {10}^{6}Pa}{10^5Pa}\right) $$
$$ W = -1.7857 \times 8.314 \times 298.15 \times \ln(20) $$
$$ W = -1.7857 \times 8.314 \times 298.15 \times 2.9957 $$
$$ W = -13300J $$
步骤 3:计算定温膨胀过程的功
定温膨胀过程的功可以用公式计算:
$$ W = -P_{ext} \Delta V $$
其中,$P_{ext}$是外压($10^5Pa$),$\Delta V$是体积变化。由于是定温过程,可以使用理想气体状态方程计算体积变化:
$$ \Delta V = V_2 - V_1 = \frac{nRT}{P_2} - \frac{nRT}{P_1} $$
代入数值计算:
$$ \Delta V = \frac{1.7857mol \times 8.314 J/mol·K \times 298.15K}{2\times {10}^{6}Pa} - \frac{1.7857mol \times 8.314 J/mol·K \times 298.15K}{10^5Pa} $$
$$ \Delta V = \frac{1.7857 \times 8.314 \times 298.15}{2\times {10}^{6}} - \frac{1.7857 \times 8.314 \times 298.15}{10^5} $$
$$ \Delta V = 0.0224m^3 - 0.448m^3 $$
$$ \Delta V = -0.4256m^3 $$
代入外压计算功:
$$ W = -10^5Pa \times (-0.4256m^3) $$
$$ W = 42560J $$
首先,计算氮气的摩尔数。氮气的摩尔质量为28g/mol,因此50g氮气的摩尔数为:
$$ n = \frac{50g}{28g/mol} = 1.7857mol $$
步骤 2:计算定温可逆压缩过程的功
定温可逆压缩过程的功可以用公式计算:
$$ W = -nRT\ln\left(\frac{P_2}{P_1}\right) $$
其中,$n$是摩尔数,$R$是理想气体常数(8.314 J/mol·K),$T$是温度(25℃=298.15K),$P_1$是初始压力($10^5Pa$),$P_2$是最终压力($2\times {10}^{6}Pa$)。
代入数值计算:
$$ W = -1.7857mol \times 8.314 J/mol·K \times 298.15K \times \ln\left(\frac{2\times {10}^{6}Pa}{10^5Pa}\right) $$
$$ W = -1.7857 \times 8.314 \times 298.15 \times \ln(20) $$
$$ W = -1.7857 \times 8.314 \times 298.15 \times 2.9957 $$
$$ W = -13300J $$
步骤 3:计算定温膨胀过程的功
定温膨胀过程的功可以用公式计算:
$$ W = -P_{ext} \Delta V $$
其中,$P_{ext}$是外压($10^5Pa$),$\Delta V$是体积变化。由于是定温过程,可以使用理想气体状态方程计算体积变化:
$$ \Delta V = V_2 - V_1 = \frac{nRT}{P_2} - \frac{nRT}{P_1} $$
代入数值计算:
$$ \Delta V = \frac{1.7857mol \times 8.314 J/mol·K \times 298.15K}{2\times {10}^{6}Pa} - \frac{1.7857mol \times 8.314 J/mol·K \times 298.15K}{10^5Pa} $$
$$ \Delta V = \frac{1.7857 \times 8.314 \times 298.15}{2\times {10}^{6}} - \frac{1.7857 \times 8.314 \times 298.15}{10^5} $$
$$ \Delta V = 0.0224m^3 - 0.448m^3 $$
$$ \Delta V = -0.4256m^3 $$
代入外压计算功:
$$ W = -10^5Pa \times (-0.4256m^3) $$
$$ W = 42560J $$