如图所示,两个大小不同的容器用均匀的细管相连,管中有一水银滴作活塞,大容器装有氧气,小容器装有氢气。当温度相同时,水银滴静止于细管中央,则此时这两种气体中( )。A、氧气的密度较大B、氢气的密度较大C、两种气体的密度一样大D、哪种气体的密度较大是无法判断的
如图所示,两个大小不同的容器用均匀的细管相连,管中有一水银滴作活塞,大容器装有氧气,小容器装有氢气。当温度相同时,水银滴静止于细管中央,则此时这两种气体中( )。
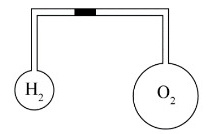
- A、氧气的密度较大
- B、氢气的密度较大
- C、两种气体的密度一样大
- D、哪种气体的密度较大是无法判断的
题目解答
答案
解析
考查要点:本题主要考查理想气体状态方程的应用,以及密度与压强、体积、摩尔质量之间的关系。
解题核心思路:
- 压强平衡:水银滴静止说明两侧气体的压强相等。
- 理想气体方程:通过压强相等的条件,结合气体体积和物质的量的关系,推导密度差异。
- 密度公式:密度由气体的总质量和体积决定,需综合考虑摩尔数和摩尔质量。
破题关键点:
- 压强相等时,体积大的容器中气体的物质的量更多。
- 密度公式为 $\rho = \frac{nM}{V}$,其中 $M$ 为摩尔质量,需比较氧气和氢气的 $\rho$。
压强平衡分析
水银滴静止,说明氧气和氢气的压强相等,即 $P_{\text{O}_2} = P_{\text{H}_2}$。
理想气体方程推导
根据理想气体方程 $PV = nRT$,可得 $\frac{n}{V} = \frac{P}{RT}$。
由于温度 $T$ 和压强 $P$ 相等,两侧气体的 $\frac{n}{V}$ 相等,即:
$\frac{n_{\text{O}_2}}{V_{\text{O}_2}} = \frac{n_{\text{H}_2}}{V_{\text{H}_2}}.$
体积与物质的量关系
大容器(氧气)体积 $V_{\text{O}_2}$ 大于小容器(氢气)体积 $V_{\text{H}_2}$,因此氧气的物质的量 $n_{\text{O}_2}$ 必然大于氢气的 $n_{\text{H}_2}$。
密度计算
密度公式为 $\rho = \frac{nM}{V}$,其中 $M$ 为摩尔质量。
- 氧气密度:$\rho_{\text{O}_2} = \frac{n_{\text{O}_2} M_{\text{O}_2}}{V_{\text{O}_2}}$
- 氢气密度:$\rho_{\text{H}_2} = \frac{n_{\text{H}_2} M_{\text{H}_2}}{V_{\text{H}_2}}$
由 $\frac{n_{\text{O}_2}}{V_{\text{O}_2}} = \frac{n_{\text{H}_2}}{V_{\text{H}_2}}$ 可得:
$\rho_{\text{O}_2} = \frac{n_{\text{O}_2}}{V_{\text{O}_2}} M_{\text{O}_2} = \frac{P}{RT} M_{\text{O}_2}, \quad \rho_{\text{H}_2} = \frac{P}{RT} M_{\text{H}_2}.$
由于氧气的摩尔质量 $M_{\text{O}_2} = 32 \, \text{g/mol}$ 远大于氢气的 $M_{\text{H}_2} = 2 \, \text{g/mol}$,因此 $\rho_{\text{O}_2} > \rho_{\text{H}_2}$。