题目
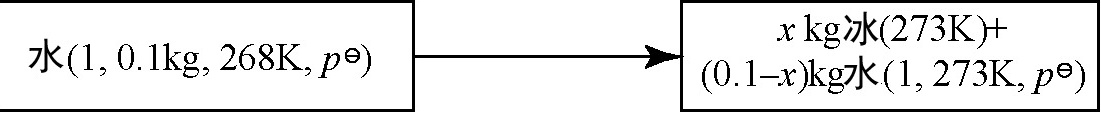
在标准压力下,把一个极小的冰块投入 0.1rm kg、268 K 的水中,结果使系统的温度变为 273 K,并有一定数量的水凝结成冰。由于过程进行得很快,可以看做是绝热的。已知冰的熔化热是 333.5 kJ⋅kg−1,在 268∼273 K 之间水的比热容为 4.21 kJ⋅kg−1⋅K−1。写出系统物态的变化,并求出 Delta H。求析出冰的质量。
在标准压力下,把一个极小的冰块投入 $0.1\rm kg$、 的水中,结果使系统的温度变为 ,并有一定数量的水凝结成冰。由于过程进行得很快,可以看做是绝热的。已知冰的熔化热是 ,在 之间水的比热容为 。
写出系统物态的变化,并求出 $\Delta H$。
求析出冰的质量。
题目解答
答案
- (1)
 ;$0$
;$0$ - (2)
解析
步骤 1:确定系统物态变化
在标准压力下,冰块投入水中,由于过程是绝热的,系统与外界没有热量交换。冰块和水的温度最终达到273 K,即冰水混合物的温度。因此,系统物态变化为:一部分水凝结成冰,另一部分水保持液态。
步骤 2:计算 $\Delta H$
由于过程是绝热的,系统与外界没有热量交换,因此 $\Delta H = 0$。
步骤 3:求析出冰的质量
设析出冰的质量为 $x$ kg,则剩余水的质量为 $(0.1 - x)$ kg。根据能量守恒,水的温度从268 K升高到273 K所吸收的热量等于冰融化成水所释放的热量。因此,可以列出以下方程:
$$
(0.1 - x) \cdot 4.21 \cdot (273 - 268) = x \cdot 333.5
$$
解这个方程,可以得到 $x$ 的值。
在标准压力下,冰块投入水中,由于过程是绝热的,系统与外界没有热量交换。冰块和水的温度最终达到273 K,即冰水混合物的温度。因此,系统物态变化为:一部分水凝结成冰,另一部分水保持液态。
步骤 2:计算 $\Delta H$
由于过程是绝热的,系统与外界没有热量交换,因此 $\Delta H = 0$。
步骤 3:求析出冰的质量
设析出冰的质量为 $x$ kg,则剩余水的质量为 $(0.1 - x)$ kg。根据能量守恒,水的温度从268 K升高到273 K所吸收的热量等于冰融化成水所释放的热量。因此,可以列出以下方程:
$$
(0.1 - x) \cdot 4.21 \cdot (273 - 268) = x \cdot 333.5
$$
解这个方程,可以得到 $x$ 的值。