题目
有一个具有活塞的容器中盛有一定量的气体,如果压缩气体并对它加热,使它的温度从27℃升到127℃,体积减少一半,求气体的压强变化为原来的多少倍?
有一个具有活塞的容器中盛有一定量的气体,如果压缩气体并对它加热,使它的温度从27℃升到127℃,体积减少一半,求气体的压强变化为原来的多少倍?
题目解答
答案
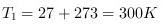
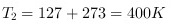
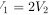
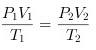
代入得: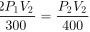
解得: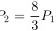
答:气体的压强变化为原来的 倍。
倍。
解析
考查要点:本题主要考查理想气体状态方程的应用,涉及温度单位转换、比例关系的建立与求解。
解题核心思路:
- 确定状态量变化:明确气体初末状态的温度、体积、压强关系。
- 应用理想气体状态方程:利用$\frac{P_1 V_1}{T_1} = \frac{P_2 V_2}{T_2}$建立方程。
- 代数运算:通过代入已知条件,解方程求出压强变化倍数。
破题关键点:
- 温度转换:将摄氏度转换为开尔文($T(K) = t(℃) + 273$)。
- 体积关系:体积减少一半,即$V_2 = \frac{1}{2}V_1$,需注意变量替换方向。
- 方程简化:通过约分消去体积$V_2$,直接求解压强比。
步骤1:确定初末状态参数
- 初始温度:$T_1 = 27℃ + 273 = 300\ \text{K}$
- 末状态温度:$T_2 = 127℃ + 273 = 400\ \text{K}$
- 体积关系:体积减少一半,即$V_2 = \frac{1}{2}V_1$,因此$V_1 = 2V_2$。
步骤2:应用理想气体状态方程
理想气体状态方程为:
$\frac{P_1 V_1}{T_1} = \frac{P_2 V_2}{T_2}$
将$V_1 = 2V_2$代入方程:
$\frac{P_1 \cdot 2V_2}{300} = \frac{P_2 \cdot V_2}{400}$
步骤3:约分与求解
两边同时除以$V_2$,消去体积项:
$\frac{2P_1}{300} = \frac{P_2}{400}$
交叉相乘得:
$2P_1 \cdot 400 = P_2 \cdot 300$
整理得:
$P_2 = \frac{2 \cdot 400}{300} P_1 = \frac{8}{3} P_1$