题目
容器内储有3.2g氧气,温度为300K,若使其等温膨胀到原来体积的二倍,求气体对外所做的功及吸收的热量。
容器内储有3.2g氧气,温度为300K,若使其等温膨胀到原来体积的二倍,求气体对外所做的功及吸收的热量。
题目解答
答案
由于该过程为等温膨胀过程,T不变,则有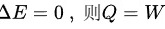
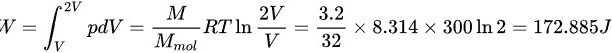
则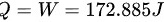
气体对外所做的功172.885J;吸收的热量172.885J。
解析
步骤 1:确定气体的摩尔数
根据题目,容器内储有3.2g氧气,氧气的摩尔质量为32g/mol,因此可以计算出氧气的摩尔数。
步骤 2:计算气体对外所做的功
由于该过程为等温膨胀过程,根据理想气体状态方程,气体对外所做的功可以表示为$W = nRT\ln\left(\frac{V_f}{V_i}\right)$,其中$n$为摩尔数,$R$为理想气体常数,$T$为温度,$V_f$为膨胀后的体积,$V_i$为膨胀前的体积。
步骤 3:计算吸收的热量
由于该过程为等温膨胀过程,根据热力学第一定律,$\Delta E = Q - W$,其中$\Delta E$为内能变化,$Q$为吸收的热量,$W$为对外所做的功。由于等温过程内能不变,即$\Delta E = 0$,因此$Q = W$。
根据题目,容器内储有3.2g氧气,氧气的摩尔质量为32g/mol,因此可以计算出氧气的摩尔数。
步骤 2:计算气体对外所做的功
由于该过程为等温膨胀过程,根据理想气体状态方程,气体对外所做的功可以表示为$W = nRT\ln\left(\frac{V_f}{V_i}\right)$,其中$n$为摩尔数,$R$为理想气体常数,$T$为温度,$V_f$为膨胀后的体积,$V_i$为膨胀前的体积。
步骤 3:计算吸收的热量
由于该过程为等温膨胀过程,根据热力学第一定律,$\Delta E = Q - W$,其中$\Delta E$为内能变化,$Q$为吸收的热量,$W$为对外所做的功。由于等温过程内能不变,即$\Delta E = 0$,因此$Q = W$。