题目
气体在某一过程吸收了60 kJ的热量,同时热力学能增加了100 kJ,此过程是膨胀过程还是压缩过程?系统与外界交换的功为( )A 膨胀过程,40 kJ B 压缩过程,40 kJ C 膨胀过程,160 kJ
气体在某一过程吸收了60 kJ的热量,同时热力学能增加了100 kJ,此过程是膨胀过程还是压缩过程?系统与外界交换的功为( )
A 膨胀过程,40 kJ
B 压缩过程,40 kJ
C 膨胀过程,160 kJ
题目解答
答案
答案是 B 压缩过程, 40 kJ。
根据热力学第一定律:
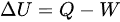
其中:
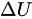 是内能的增加(100 kJ);
是内能的增加(100 kJ);
Q 是吸收的热量(60 kJ);
W 是系统对外做的功。
将已知值代入公式:
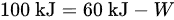
解得:
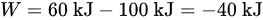
负号表示系统从外界获得了40 kJ的功,也就是说这是一个压缩过程,因为外界对系统做功。
因此,正确答案是 B 压缩过程, 40 kJ。
解析
考查要点:本题主要考查热力学第一定律的应用,重点在于理解功的正负与过程类型(膨胀或压缩)的关系。
解题核心思路:
- 热力学第一定律公式:$\Delta U = Q - W$(其中$\Delta U$为内能变化,$Q$为吸收的热量,$W$为系统对外做的功)。
- 符号约定:若计算结果$W > 0$,表示系统对外做功(膨胀过程);若$W < 0$,表示外界对系统做功(压缩过程)。
- 关键判断:通过$\Delta U$和$Q$的数值关系,计算$W$的值,进而判断过程类型。
已知条件:
- 气体吸收的热量 $Q = 60 \, \text{kJ}$
- 内能的增加 $\Delta U = 100 \, \text{kJ}$
代入热力学第一定律公式:
$\Delta U = Q - W \implies 100 = 60 - W$
解方程求$W$:
$W = 60 - 100 = -40 \, \text{kJ}$
分析结果:
- $W = -40 \, \text{kJ}$ 表示系统对外做的功为负,即外界对系统做了$40 \, \text{kJ}$的功。
- 外界对系统做功对应压缩过程。