题目
4.将500J的热量传给标准状态下22mol的氢。若温度不变,热量变为什么?氢的压强-|||-及体积各变为多少?

题目解答
答案
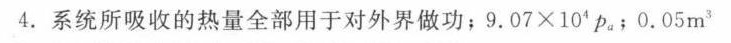
解析
步骤 1:确定氢气的状态方程
氢气在标准状态下,可以视为理想气体,其状态方程为 $PV=nRT$,其中 $P$ 为压强,$V$ 为体积,$n$ 为物质的量,$R$ 为理想气体常数,$T$ 为温度。
步骤 2:计算氢气的初始体积
在标准状态下,$T=273.15K$,$P=101325Pa$,$n=22mol$,$R=8.314J/(mol\cdot K)$,代入状态方程计算初始体积 $V$。
$$V=\frac{nRT}{P}=\frac{22\times 8.314\times 273.15}{101325}=0.5m^3$$
步骤 3:确定热量的用途
由于温度不变,根据热力学第一定律,热量全部用于对外界做功,即 $Q=W$,其中 $Q$ 为热量,$W$ 为功。
步骤 4:计算氢气的最终体积
由于温度不变,根据玻意耳定律,$P_1V_1=P_2V_2$,其中 $P_1$ 和 $V_1$ 为初始状态的压强和体积,$P_2$ 和 $V_2$ 为最终状态的压强和体积。由于热量全部用于对外界做功,体积会增大,压强会减小。根据理想气体状态方程,$P_2V_2=nRT$,代入 $P_2$ 和 $V_2$ 计算。
$$P_2=\frac{nRT}{V_2}$$
$$V_2=\frac{W}{P_1}+V_1=\frac{500}{101325}+0.5=0.5049m^3$$
$$P_2=\frac{22\times 8.314\times 273.15}{0.5049}=9.07\times {10}^{4}Pa$$
氢气在标准状态下,可以视为理想气体,其状态方程为 $PV=nRT$,其中 $P$ 为压强,$V$ 为体积,$n$ 为物质的量,$R$ 为理想气体常数,$T$ 为温度。
步骤 2:计算氢气的初始体积
在标准状态下,$T=273.15K$,$P=101325Pa$,$n=22mol$,$R=8.314J/(mol\cdot K)$,代入状态方程计算初始体积 $V$。
$$V=\frac{nRT}{P}=\frac{22\times 8.314\times 273.15}{101325}=0.5m^3$$
步骤 3:确定热量的用途
由于温度不变,根据热力学第一定律,热量全部用于对外界做功,即 $Q=W$,其中 $Q$ 为热量,$W$ 为功。
步骤 4:计算氢气的最终体积
由于温度不变,根据玻意耳定律,$P_1V_1=P_2V_2$,其中 $P_1$ 和 $V_1$ 为初始状态的压强和体积,$P_2$ 和 $V_2$ 为最终状态的压强和体积。由于热量全部用于对外界做功,体积会增大,压强会减小。根据理想气体状态方程,$P_2V_2=nRT$,代入 $P_2$ 和 $V_2$ 计算。
$$P_2=\frac{nRT}{V_2}$$
$$V_2=\frac{W}{P_1}+V_1=\frac{500}{101325}+0.5=0.5049m^3$$
$$P_2=\frac{22\times 8.314\times 273.15}{0.5049}=9.07\times {10}^{4}Pa$$