题目
如图所示,使1mol氧气(1)由A等温地变到B;(2)由A等体地变到C,再由C等压地变到B.试分别计算氧气所作的功和吸收的热量.2 --- A-|||-C B-|||-0-|||-1 2-|||-V/(2.0×10^(-2)m^3)2.0×10^(-2)m^3)
如图所示,使1mol氧气(1)由A等温地变到B;(2)由A等体地变到C,再由C等压地变到B.试分别计算氧气所作的功和吸收的热量.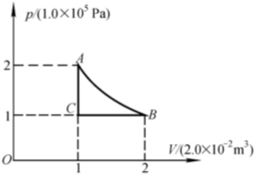
题目解答
答案
答案:

解析
步骤 1:计算等温过程AB的功
在等温过程中,理想气体的内能不变,即 $\Delta E = 0$。根据热力学第一定律 $Q = W + \Delta E$,可以得出 $Q = W$。等温过程中,气体对外做的功可以通过公式 $W = nRT \ln \left(\frac{V_B}{V_A}\right)$ 计算,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T$ 是温度,$V_B$ 和 $V_A$ 分别是终态和初态的体积。由于 $pV = nRT$,可以将 $W$ 表示为 $W = p_A V_A \ln \left(\frac{V_B}{V_A}\right)$。
步骤 2:计算等体过程AC的功
在等体过程中,体积不变,因此气体对外做的功为零,即 $W_{AC} = 0$。
步骤 3:计算等压过程CB的功
在等压过程中,气体对外做的功可以通过公式 $W = p \Delta V$ 计算,其中 $p$ 是压力,$\Delta V$ 是体积的变化量。由于 $p$ 是常数,可以将 $W$ 表示为 $W_{CB} = p_C (V_B - V_C)$。
步骤 4:计算等温过程AB的热量
在等温过程中,气体吸收的热量等于气体对外做的功,即 $Q_{AB} = W_{AB}$。
步骤 5:计算等体过程AC的热量
在等体过程中,气体吸收的热量等于内能的增加,即 $Q_{AC} = \Delta E_{AC}$。由于 $C_V$ 是摩尔定体热容,可以将 $Q_{AC}$ 表示为 $Q_{AC} = n C_V \Delta T$。
步骤 6:计算等压过程CB的热量
在等压过程中,气体吸收的热量等于内能的增加加上气体对外做的功,即 $Q_{CB} = \Delta E_{CB} + W_{CB}$。由于 $C_P$ 是摩尔定压热容,可以将 $Q_{CB}$ 表示为 $Q_{CB} = n C_P \Delta T$。
步骤 7:计算总热量
在过程ACB中,气体吸收的总热量等于各过程热量之和,即 $Q_{ACB} = Q_{AC} + Q_{CB}$。
在等温过程中,理想气体的内能不变,即 $\Delta E = 0$。根据热力学第一定律 $Q = W + \Delta E$,可以得出 $Q = W$。等温过程中,气体对外做的功可以通过公式 $W = nRT \ln \left(\frac{V_B}{V_A}\right)$ 计算,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T$ 是温度,$V_B$ 和 $V_A$ 分别是终态和初态的体积。由于 $pV = nRT$,可以将 $W$ 表示为 $W = p_A V_A \ln \left(\frac{V_B}{V_A}\right)$。
步骤 2:计算等体过程AC的功
在等体过程中,体积不变,因此气体对外做的功为零,即 $W_{AC} = 0$。
步骤 3:计算等压过程CB的功
在等压过程中,气体对外做的功可以通过公式 $W = p \Delta V$ 计算,其中 $p$ 是压力,$\Delta V$ 是体积的变化量。由于 $p$ 是常数,可以将 $W$ 表示为 $W_{CB} = p_C (V_B - V_C)$。
步骤 4:计算等温过程AB的热量
在等温过程中,气体吸收的热量等于气体对外做的功,即 $Q_{AB} = W_{AB}$。
步骤 5:计算等体过程AC的热量
在等体过程中,气体吸收的热量等于内能的增加,即 $Q_{AC} = \Delta E_{AC}$。由于 $C_V$ 是摩尔定体热容,可以将 $Q_{AC}$ 表示为 $Q_{AC} = n C_V \Delta T$。
步骤 6:计算等压过程CB的热量
在等压过程中,气体吸收的热量等于内能的增加加上气体对外做的功,即 $Q_{CB} = \Delta E_{CB} + W_{CB}$。由于 $C_P$ 是摩尔定压热容,可以将 $Q_{CB}$ 表示为 $Q_{CB} = n C_P \Delta T$。
步骤 7:计算总热量
在过程ACB中,气体吸收的总热量等于各过程热量之和,即 $Q_{ACB} = Q_{AC} + Q_{CB}$。