题目
处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们()(A)温度、压强均不相同(B)温度相同,但氦气压强大于氮气的压强(C)温度、压强都相同(D)温度相同,但氦气压强小于氮气的压强
处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们()
(A)温度、压强均不相同
(B)温度相同,但氦气压强大于氮气的压强
(C)温度、压强都相同
(D)温度相同,但氦气压强小于氮气的压强
题目解答
答案
根据理想气体状态方程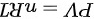 可以得知处于平衡状态的两种气体,分子数密度相同且分子的平均平动动能相同,意味着它们满足相同的状态方程。
可以得知处于平衡状态的两种气体,分子数密度相同且分子的平均平动动能相同,意味着它们满足相同的状态方程。
由此,我们可以比较两种气体的压强和温度。从状态方程可知,相同分子数密度和分子平均平动动能意味着它们的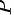 、
、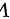 、
、 之间的关系是一样的。因此,它们的温度和压强都是相同的.
之间的关系是一样的。因此,它们的温度和压强都是相同的.
故选C
解析
考查要点:本题主要考查理想气体状态方程的理解与应用,以及分子平均平动动能与温度的关系。
解题核心思路:
- 分子平均平动动能与温度的关系:根据热力学知识,分子平均平动动能 $\overline{e_k} = \frac{3}{2}kT$,因此当平均平动动能相同时,温度 $T$ 必然相同。
- 理想气体状态方程:压强公式 $P = nRT$($n$ 为分子数密度,$R$ 为普适气体常数)。当 $n$ 和 $T$ 相同时,压强 $P$ 必然相等。
破题关键点:
- 明确氦气和氮气均为理想气体,状态方程形式相同。
- 温度由分子平均平动动能唯一决定,压强由分子数密度和温度共同决定。
步骤1:分析温度关系
根据分子平均平动动能公式 $\overline{e_k} = \frac{3}{2}kT$,题目中两种气体的 $\overline{e_k}$ 相同,且 $k$ 为常数,因此它们的温度 $T$ 必然相等。
步骤2:分析压强关系
理想气体压强公式为 $P = nRT$。题目中两种气体的分子数密度 $n$ 相同,温度 $T$ 相同,且 $R$ 为普适气体常数(与气体种类无关),因此它们的压强 $P$ 也必然相等。
结论
两种气体的温度和压强均相同,故正确答案为 C。