题目
⑴ 根据量子力学理论,氢原子中电子的运动状态可用n,,m,m s四个量子数来描述。试说明它们各自确定什么物理量?⑵ 根据薛定谔方程解出的氢原子角动量量子化条件与玻尔理论的量子化条件有何区别?⑶ 试求d分壳层最多能容纳的电子数,并写出这些电子的m和m s值。⑷ 一价金属钠原子,核外共有11个电子,当钠原子处于基态时,根据泡利不相容原理,其价电子可能取的量子态数为[ ]。(11,14,16,18)
⑴ 根据量子力学理论,氢原子中电子的运动状态可用n,,m,m s四个量子数来描述。试说明它们各自确定什么物理量?
⑵ 根据薛定谔方程解出的氢原子角动量量子化条件与玻尔理论的量子化条件有何区别?
⑶ 试求d分壳层最多能容纳的电子数,并写出这些电子的m和m s值。
⑷ 一价金属钠原子,核外共有11个电子,当钠原子处于基态时,根据泡利不相容原理,其价电子可能取的量子态数为[ ]。(11,14,16,18)
题目解答
答案
解:⑴主量子数n,大体上确定原子中电子的能量;
角量子数,确定电子轨道的角动量;
磁量子数m,确定轨道角动量在外磁场方向上的分量;
自旋磁量子数m s,确定自旋角动量在外磁场方向上的分量。
⑵ 根据薛定谔方程解出的氢原子角动量量子化条件:L=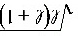 h 2(=0,1,2,3n1)最小值为0;玻尔理论的量子化条件:L= nh 2(n=1,2,3),最小值为h 2。
h 2(=0,1,2,3n1)最小值为0;玻尔理论的量子化条件:L= nh 2(n=1,2,3),最小值为h 2。
⑶ d壳层就是角量子数=2的分壳层,最多能容纳的电子数为:
Z=2(2+1)=2(22+1)=10个,m=0,1,2;m s=1 2。
⑷ 一价金属钠原子处于基态,即核外共有11个电子依次填满各最低能级,1s22s22p63s1,即价电子在n=3即M壳层,此时n=3为该原子基态,由于n大体上确定原子中电子的能量,电子在n=3壳层中各量子态均为基态,n4不为基态,∴量子态数为2n2=232=18。
解析
步骤 1:量子数的物理意义
- 主量子数n:确定电子的能量和电子所在的壳层。
- 角量子数:确定电子轨道的角动量和电子所在的亚壳层。
- 磁量子数m:确定轨道角动量在磁场方向上的分量,即电子轨道的取向。
- 自旋磁量子数m s:确定电子自旋角动量在磁场方向上的分量,即电子的自旋状态。
步骤 2:薛定谔方程解出的氢原子角动量量子化条件与玻尔理论的量子化条件的区别
- 薛定谔方程解出的氢原子角动量量子化条件:L=$\sqrt {e(e+1)}$h 2(=0,1,2,3n1),最小值为0。
- 玻尔理论的量子化条件:L= nh 2(n=1,2,3),最小值为h 2。
步骤 3:d分壳层最多能容纳的电子数
- d分壳层对应角量子数=2,最多能容纳的电子数为:Z=2(2+1)=2(22+1)=10个。
- m=0,1,2;m s=1 2。
步骤 4:一价金属钠原子处于基态时,价电子可能取的量子态数
- 一价金属钠原子处于基态,即核外共有11个电子依次填满各最低能级,1s22s22p63s1,即价电子在n=3即M壳层,此时n=3为该原子基态。
- 由于n大体上确定原子中电子的能量,电子在n=3壳层中各量子态均为基态,n4不为基态,∴量子态数为2n2=232=18。
- 主量子数n:确定电子的能量和电子所在的壳层。
- 角量子数:确定电子轨道的角动量和电子所在的亚壳层。
- 磁量子数m:确定轨道角动量在磁场方向上的分量,即电子轨道的取向。
- 自旋磁量子数m s:确定电子自旋角动量在磁场方向上的分量,即电子的自旋状态。
步骤 2:薛定谔方程解出的氢原子角动量量子化条件与玻尔理论的量子化条件的区别
- 薛定谔方程解出的氢原子角动量量子化条件:L=$\sqrt {e(e+1)}$h 2(=0,1,2,3n1),最小值为0。
- 玻尔理论的量子化条件:L= nh 2(n=1,2,3),最小值为h 2。
步骤 3:d分壳层最多能容纳的电子数
- d分壳层对应角量子数=2,最多能容纳的电子数为:Z=2(2+1)=2(22+1)=10个。
- m=0,1,2;m s=1 2。
步骤 4:一价金属钠原子处于基态时,价电子可能取的量子态数
- 一价金属钠原子处于基态,即核外共有11个电子依次填满各最低能级,1s22s22p63s1,即价电子在n=3即M壳层,此时n=3为该原子基态。
- 由于n大体上确定原子中电子的能量,电子在n=3壳层中各量子态均为基态,n4不为基态,∴量子态数为2n2=232=18。