题目
3.2 一体积为 https:/img.zuoyebang.cc/zyb_1234376234f48954ff1cceaba89aa3d3.jpg.0times (10)^-3(m)^3 的容器中,含有 .0times (10)^-5kg 氦气和 .0times (10)^-5kg 氢-|||-气,它们的温度为27 ℃,试求容器中混合气体的压强。

题目解答
答案
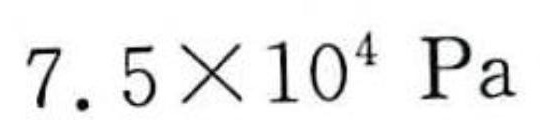
解析
考查要点:本题主要考查理想气体状态方程的应用,涉及混合气体压强的计算。
解题思路:
- 确定温度单位:将摄氏温度转换为热力学温度。
- 计算各气体的物质的量:利用质量与摩尔质量的关系分别求出氦气和氢气的物质的量。
- 总物质的量叠加:混合气体的总物质的量为两气体物质的量之和。
- 应用理想气体方程:用总物质的量代入公式 $P = \frac{nRT}{V}$ 计算总压强。
关键点:
- 混合气体的压强等于各分气体积相同、温度相同条件下的分压强之和,可用总物质的量直接计算。
- 单位统一:温度需转换为开尔文,质量与摩尔质量单位需匹配。
步骤1:温度转换
题目中温度为 $27^\circ \text{C}$,转换为热力学温度:
$T = 27 + 273 = 300 \, \text{K}$
步骤2:计算氦气和氢气的物质的量
- 氦气(He):摩尔质量 $M_{\text{He}} = 4.0 \, \text{g/mol} = 0.004 \, \text{kg/mol}$
$n_{\text{He}} = \frac{m_{\text{He}}}{M_{\text{He}}} = \frac{4.0 \times 10^{-5} \, \text{kg}}{0.004 \, \text{kg/mol}} = 0.01 \, \text{mol}$ - 氢气(H₂):摩尔质量 $M_{\text{H}_2} = 2.0 \, \text{g/mol} = 0.002 \, \text{kg/mol}$
$n_{\text{H}_2} = \frac{m_{\text{H}_2}}{M_{\text{H}_2}} = \frac{4.0 \times 10^{-5} \, \text{kg}}{0.002 \, \text{kg/mol}} = 0.02 \, \text{mol}$
步骤3:总物质的量
$n_{\text{总}} = n_{\text{He}} + n_{\text{H}_2} = 0.01 \, \text{mol} + 0.02 \, \text{mol} = 0.03 \, \text{mol}$
步骤4:计算总压强
代入理想气体方程 $P = \frac{nRT}{V}$:
$P = \frac{0.03 \, \text{mol} \times 8.314 \, \text{J/(mol·K)} \times 300 \, \text{K}}{1.0 \times 10^{-3} \, \text{m}^3}$
计算得:
$P = \frac{0.03 \times 8.314 \times 300}{0.001} = 7.5 \times 10^4 \, \text{Pa}$