题目
2. (e)^+ 离子中3s,3p,3d,4s轨道能量关系为 ()-|||-A _(3s)lt (E)_(3p)lt (E)_(3)lt (L)_(4s) B _(3s)=(E)_(3p)=(F)_(3d)lt (E)_(4s)-|||-C _(3s)=(E)_(3p)=(E)_(3)d=(E)_(4s) D _(3s)lt (E)_(3p)lt (E)_(4s)lt (E)_(3d)
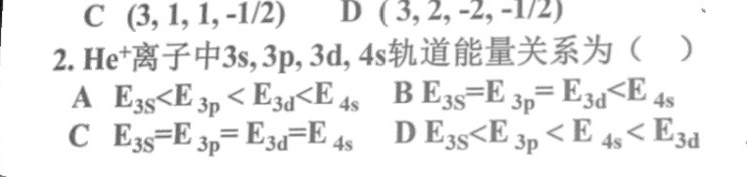
题目解答
答案

解析
步骤 1:理解题目
题目要求我们确定${He}^{+}$离子中3s,3p,3d,4s轨道的能量关系。${He}^{+}$离子只有一个电子,因此,我们只需要考虑单电子原子的轨道能量关系。
步骤 2:单电子原子轨道能量
在单电子原子中,轨道能量主要由主量子数$n$决定,而角量子数$l$对能量的影响较小。对于同一个主量子数$n$,不同角量子数$l$的轨道能量几乎相等。因此,对于${He}^{+}$离子,3s,3p,3d轨道的能量几乎相等,而4s轨道的能量较高。
步骤 3:确定能量关系
根据上述分析,我们可以得出${He}^{+}$离子中3s,3p,3d轨道的能量几乎相等,而4s轨道的能量较高。因此,能量关系为${E}_{3s}={E}_{3p}={E}_{3d}\lt {E}_{4s}$。
题目要求我们确定${He}^{+}$离子中3s,3p,3d,4s轨道的能量关系。${He}^{+}$离子只有一个电子,因此,我们只需要考虑单电子原子的轨道能量关系。
步骤 2:单电子原子轨道能量
在单电子原子中,轨道能量主要由主量子数$n$决定,而角量子数$l$对能量的影响较小。对于同一个主量子数$n$,不同角量子数$l$的轨道能量几乎相等。因此,对于${He}^{+}$离子,3s,3p,3d轨道的能量几乎相等,而4s轨道的能量较高。
步骤 3:确定能量关系
根据上述分析,我们可以得出${He}^{+}$离子中3s,3p,3d轨道的能量几乎相等,而4s轨道的能量较高。因此,能量关系为${E}_{3s}={E}_{3p}={E}_{3d}\lt {E}_{4s}$。