题目
一定质量的理想气体,先经过等体过程使其热力学温度升高一倍,再经过等温过程使其体积膨胀为原来的两倍, 则分子的平均自由程变为原来的____倍。
一定质量的理想气体,先经过等体过程使其热力学温度升高一倍,再经过等温过程使其体积膨胀为原来的两倍, 则分子的平均自由程变为原来的____倍。
题目解答
答案
在理想气体的情况下,分子的平均自由程与气体分子数密度和碰撞概率有关。根据平均自由程的定义,我们可以得出以下关系:
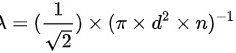
其中,λ表示分子的平均自由程,d表示分子的直径,n表示气体的分子数密度。
根据题目中的条件变化,我们可以逐步求解问题:
1. 等体过程使热力学温度升高一倍。
由于等体过程,体积不变,所以分子数密度n不变。
根据理想气体状态方程 PV = nRT,温度T与分子数密度n成正比。
假设原始温度为T0,升高一倍后的温度为2T0。
2. 等温过程使体积膨胀为原来的两倍。
在等温过程中,温度保持不变。根据理想气体状态方程 PV = nRT,
当体积V扩大为原来的两倍时,分子数密度n减少一半。
在等体过程使温度升高一倍后,分子数密度n保持不变。而在等温过程使体积膨胀为原来的两倍后,分子数密度减少一半。因此,分子的平均自由程变为原来的2倍。
解析
考查要点:本题主要考查理想气体分子平均自由程与分子数密度的关系,以及理想气体状态方程在等体、等温过程中的应用。
解题核心思路:
- 分子平均自由程公式:$\lambda = \frac{1}{\sqrt{2} \pi d^2 n}$,其中$n$为分子数密度,$\lambda$与$n$成反比。
- 等体过程:体积不变,温度升高一倍,分子数密度$n$保持不变。
- 等温过程:温度不变,体积膨胀为原来的两倍,分子数密度$n$减半。
- 综合分析:两次过程后,分子数密度$n$变为原来的$\frac{1}{2}$,因此平均自由程$\lambda$变为原来的$2$倍。
破题关键点:
- 明确分子平均自由程与$n$的关系。
- 分步分析等体、等温过程对$n$的影响。
步骤1:等体过程分析
- 条件:体积$V$不变,温度$T$升高一倍。
- 理想气体状态方程:$PV = nRT$,体积$V$不变时,压强$P$与温度$T$成正比。
- 分子数密度$n$:由于气体质量不变,体积$V$不变,分子总数$N = nV$不变,因此$n$保持不变。
步骤2:等温过程分析
- 条件:温度$T$不变,体积$V$膨胀为原来的两倍。
- 理想气体状态方程:$PV = nRT$,温度$T$不变时,压强$P$与体积$V$成反比,即$P \propto \frac{1}{V}$。
- 分子数密度$n$:$n = \frac{P}{RT}$,当$P$减半时,$n$变为原来的$\frac{1}{2}$。
步骤3:平均自由程计算
- 初始状态:分子数密度为$n_0$,平均自由程$\lambda_0 = \frac{1}{\sqrt{2} \pi d^2 n_0}$。
- 等体过程后:$n = n_0$,$\lambda = \lambda_0$。
- 等温过程后:$n = \frac{n_0}{2}$,$\lambda = \frac{1}{\sqrt{2} \pi d^2 \cdot \frac{n_0}{2}} = 2\lambda_0$。