题目
装有氧气和装有氢气的两容器的P、V、T 相等则两容器中的( A ) 气体密度相等,分子数密度相等 ( B ) 气体密度不等,分子数密度不等( C ) 气体密度相等,分子数密度不等 ( D ) 气体密度不等,分子数密度相等
装有氧气和装有氢气的两容器的P、V、T 相等则两容器中的
( A ) 气体密度相等,分子数密度相等
( B ) 气体密度不等,分子数密度不等
( C ) 气体密度相等,分子数密度不等
( D ) 气体密度不等,分子数密度相等
题目解答
答案
氧气和氢气的P、V、T相同,由理想气体状态方程pV=nRT得,氢气氧气的物质的量n相同,但两气体中,氧气的相对摩尔质量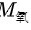 大于氢气的相对摩尔质量
大于氢气的相对摩尔质量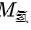 ,根据m=nM,可得氧气的质量大于氢气的质量,因此,二者的气体密度不等,排除A、C。已知两者的物质的量n相等,阿伏伽德罗
,根据m=nM,可得氧气的质量大于氢气的质量,因此,二者的气体密度不等,排除A、C。已知两者的物质的量n相等,阿伏伽德罗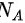 ,是常数,说明氧气和氢气的分子数相等,分子数密度也相等,故答案选D。
,是常数,说明氧气和氢气的分子数相等,分子数密度也相等,故答案选D。
解析
步骤 1:理想气体状态方程
根据理想气体状态方程 pV = nRT,其中 p 为压强,V 为体积,n 为物质的量,R 为理想气体常数,T 为温度。当两容器的 P、V、T 相等时,可以得出两容器中气体的物质的量 n 相等。
步骤 2:气体密度的计算
气体密度 ρ = m/V,其中 m 为气体的质量,V 为气体的体积。由于氧气和氢气的相对摩尔质量不同,氧气的相对摩尔质量大于氢气的相对摩尔质量,因此在物质的量相等的情况下,氧气的质量大于氢气的质量,所以氧气的密度大于氢气的密度。
步骤 3:分子数密度的计算
分子数密度 = n/V,其中 n 为物质的量,V 为体积。由于两容器的 P、V、T 相等,根据理想气体状态方程,两容器中气体的物质的量 n 相等,因此两容器中气体的分子数密度相等。
根据理想气体状态方程 pV = nRT,其中 p 为压强,V 为体积,n 为物质的量,R 为理想气体常数,T 为温度。当两容器的 P、V、T 相等时,可以得出两容器中气体的物质的量 n 相等。
步骤 2:气体密度的计算
气体密度 ρ = m/V,其中 m 为气体的质量,V 为气体的体积。由于氧气和氢气的相对摩尔质量不同,氧气的相对摩尔质量大于氢气的相对摩尔质量,因此在物质的量相等的情况下,氧气的质量大于氢气的质量,所以氧气的密度大于氢气的密度。
步骤 3:分子数密度的计算
分子数密度 = n/V,其中 n 为物质的量,V 为体积。由于两容器的 P、V、T 相等,根据理想气体状态方程,两容器中气体的物质的量 n 相等,因此两容器中气体的分子数密度相等。