题目
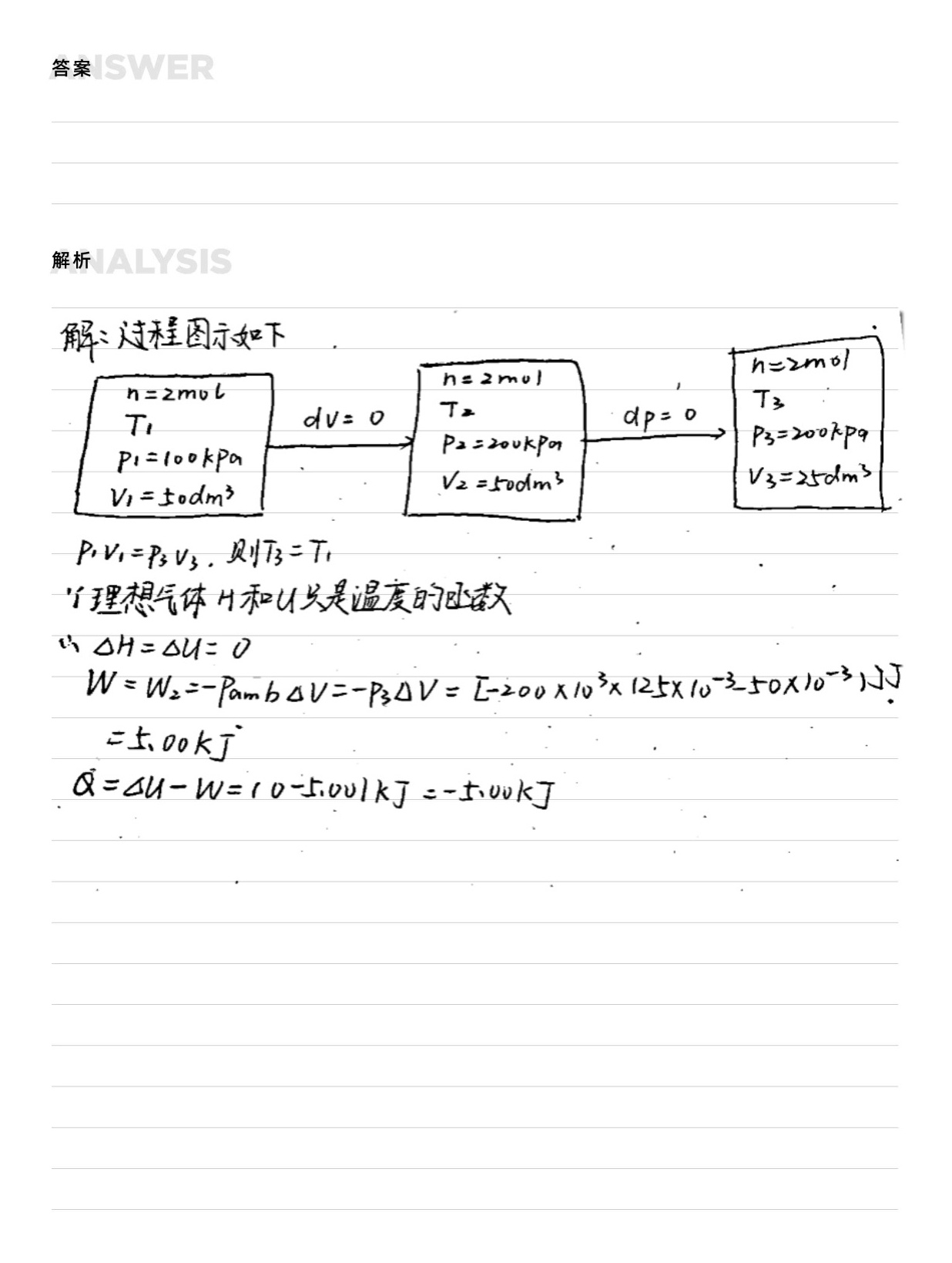
2.4 2mol某理想气体的 _(p,m)=3.5R 由始态100kPa、50 dm^3,先恒容加热使压力升高-|||-到200kPa,再恒压冷却使体积缩小至25 dm^3。求整个过程的W、Q、 △U、 Delta H-|||-答: =5.00kJ, Q=-5.00kJ Delta U=0 Delta H=0

题目解答
答案
解析
步骤 1:确定过程的性质
- 过程分为两部分:恒容加热和恒压冷却。
- 恒容加热过程中,体积不变,所以对外做功为零,即 $W_1 = 0$。
- 恒压冷却过程中,体积变化,所以对外做功为 $W_2 = -P\Delta V$。
步骤 2:计算恒容加热过程中的热量
- 恒容加热过程中,热量全部用于增加内能,即 $Q_1 = \Delta U_1$。
- 根据理想气体状态方程,$PV = nRT$,可以计算出温度变化。
- 内能变化 $\Delta U_1 = nC_{v,m}\Delta T$,其中 $C_{v,m} = C_{p,m} - R = 3.5R - R = 2.5R$。
步骤 3:计算恒压冷却过程中的热量
- 恒压冷却过程中,热量用于改变内能和对外做功,即 $Q_2 = \Delta U_2 + W_2$。
- 内能变化 $\Delta U_2 = nC_{v,m}\Delta T$。
- 对外做功 $W_2 = -P\Delta V$。
步骤 4:计算整个过程的总功、总热量、内能变化和焓变
- 总功 $W = W_1 + W_2$。
- 总热量 $Q = Q_1 + Q_2$。
- 内能变化 $\Delta U = \Delta U_1 + \Delta U_2$。
- 焓变 $\Delta H = \Delta U + \Delta (PV)$。
- 过程分为两部分:恒容加热和恒压冷却。
- 恒容加热过程中,体积不变,所以对外做功为零,即 $W_1 = 0$。
- 恒压冷却过程中,体积变化,所以对外做功为 $W_2 = -P\Delta V$。
步骤 2:计算恒容加热过程中的热量
- 恒容加热过程中,热量全部用于增加内能,即 $Q_1 = \Delta U_1$。
- 根据理想气体状态方程,$PV = nRT$,可以计算出温度变化。
- 内能变化 $\Delta U_1 = nC_{v,m}\Delta T$,其中 $C_{v,m} = C_{p,m} - R = 3.5R - R = 2.5R$。
步骤 3:计算恒压冷却过程中的热量
- 恒压冷却过程中,热量用于改变内能和对外做功,即 $Q_2 = \Delta U_2 + W_2$。
- 内能变化 $\Delta U_2 = nC_{v,m}\Delta T$。
- 对外做功 $W_2 = -P\Delta V$。
步骤 4:计算整个过程的总功、总热量、内能变化和焓变
- 总功 $W = W_1 + W_2$。
- 总热量 $Q = Q_1 + Q_2$。
- 内能变化 $\Delta U = \Delta U_1 + \Delta U_2$。
- 焓变 $\Delta H = \Delta U + \Delta (PV)$。