题目
-21mol 单原子分子理想气体,始态为 _(1)=202 650 pa _(1)=273k, 沿可逆途径 /v=a 常数)至-|||-终态,压力增加一倍计算V1,V2,T2, Delta C, Delta H, Q,W及该气体沿此途径的热容C。
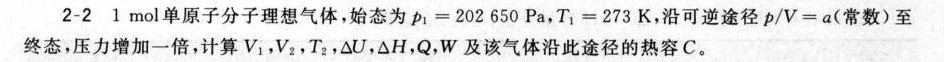
题目解答
答案
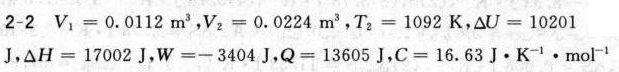
解析
步骤 1:计算初始体积 $V_1$
根据理想气体状态方程 $pV=nRT$,其中 $n=1mol$,$R=8.314J\cdot mol^{-1}\cdot K^{-1}$,$T_1=273K$,$p_1=202650Pa$,可以计算出初始体积 $V_1$。
步骤 2:计算终态体积 $V_2$
由于压力增加一倍,即 $p_2=2p_1$,根据理想气体状态方程,可以计算出终态体积 $V_2$。
步骤 3:计算终态温度 $T_2$
根据理想气体状态方程,可以计算出终态温度 $T_2$。
步骤 4:计算内能变化 $\Delta U$
对于单原子理想气体,内能变化 $\Delta U = \frac{3}{2}nR\Delta T$,其中 $\Delta T = T_2 - T_1$。
步骤 5:计算焓变 $\Delta H$
对于单原子理想气体,焓变 $\Delta H = \frac{5}{2}nR\Delta T$。
步骤 6:计算功 $W$
根据理想气体的可逆过程,$W = -nRT\ln\frac{V_2}{V_1}$。
步骤 7:计算热 $Q$
根据热力学第一定律,$Q = \Delta U + W$。
步骤 8:计算热容 $C$
热容 $C = \frac{Q}{\Delta T}$。
根据理想气体状态方程 $pV=nRT$,其中 $n=1mol$,$R=8.314J\cdot mol^{-1}\cdot K^{-1}$,$T_1=273K$,$p_1=202650Pa$,可以计算出初始体积 $V_1$。
步骤 2:计算终态体积 $V_2$
由于压力增加一倍,即 $p_2=2p_1$,根据理想气体状态方程,可以计算出终态体积 $V_2$。
步骤 3:计算终态温度 $T_2$
根据理想气体状态方程,可以计算出终态温度 $T_2$。
步骤 4:计算内能变化 $\Delta U$
对于单原子理想气体,内能变化 $\Delta U = \frac{3}{2}nR\Delta T$,其中 $\Delta T = T_2 - T_1$。
步骤 5:计算焓变 $\Delta H$
对于单原子理想气体,焓变 $\Delta H = \frac{5}{2}nR\Delta T$。
步骤 6:计算功 $W$
根据理想气体的可逆过程,$W = -nRT\ln\frac{V_2}{V_1}$。
步骤 7:计算热 $Q$
根据热力学第一定律,$Q = \Delta U + W$。
步骤 8:计算热容 $C$
热容 $C = \frac{Q}{\Delta T}$。