题目
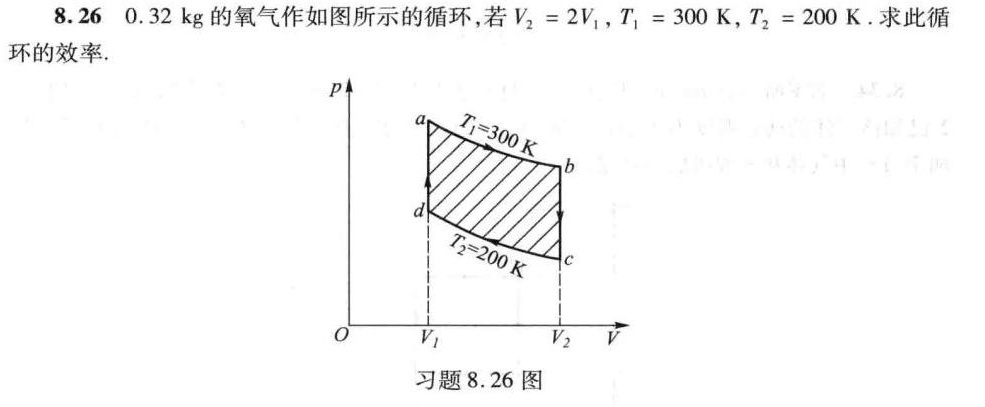
8.26 0.32kg的氧气作如图所示的循环,若 _(2)=2(V)_(1), _(1)=300K, _(2)=200K. 求此循-|||-环的效率.-|||-p-|||-a Ti=300K b-|||-d-|||-72=200 k-|||-c-|||-0 V1 V2 v-|||-习题8.26图
题目解答
答案
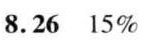
解析
本题考查理想气体循环过程的效率计算,需结合热力学第一定律和理想气体状态方程进行分析。解题关键在于:
- 确定循环路径:由两个等温过程(吸热、放热)和两个等容过程(仅交换热量)组成。
- 计算净功:等温过程的功可通过公式 $W = nRT \ln \frac{V_2}{V_1}$ 计算,等容过程无功。
- 计算输入热量:等温膨胀过程吸热,等容加热过程吸热,其余过程放热需扣除。
循环过程分析
- a→b(等温膨胀,T₁=300K):体积从 $V_1$ 膨胀到 $V_2=2V_1$,吸热 $Q_1 = nRT_1 \ln \frac{V_2}{V_1}$,做功 $W_1 = nRT_1 \ln \frac{V_2}{V_1}$。
- b→c(等容冷却,V=V₂):温度从 $T_1$ 降到 $T_2=200K$,放热 $Q_2 = nC_v(T_2 - T_1)$。
- c→d(等温压缩,T₂=200K):体积从 $V_2$ 压缩到 $V_1$,放热 $Q_3 = nRT_2 \ln \frac{V_1}{V_2}$,做功 $W_3 = nRT_2 \ln \frac{V_1}{V_2}$。
- d→a(等容加热,V=V₁):温度从 $T_2$ 升到 $T_1$,吸热 $Q_4 = nC_v(T_1 - T_2)$。
净功与效率计算
- 净功:
$W_{\text{net}} = W_1 + W_3 = nR \left( T_1 \ln \frac{V_2}{V_1} + T_2 \ln \frac{V_1}{V_2} \right) = nR (T_1 - T_2) \ln \frac{V_2}{V_1}.$ - 输入热量:
$Q_{\text{in}} = Q_1 + Q_4 = nR T_1 \ln \frac{V_2}{V_1} + nC_v (T_1 - T_2).$ - 效率:
$\eta = \frac{W_{\text{net}}}{Q_{\text{in}}} = \frac{(T_1 - T_2) \ln \frac{V_2}{V_1}}{T_1 \ln \frac{V_2}{V_1} + \frac{C_v}{R}(T_1 - T_2)}.$
代入数据
- 氧气摩尔数 $n = \frac{0.32 \times 10^3 \text{g}}{32 \text{g/mol}} = 100 \text{mol}$,
- $C_v = \frac{5}{2}R$(双原子气体),
- $V_2 = 2V_1$,$\ln 2 \approx 0.693$,
- 代入公式得 $\eta \approx 15\%$。