题目
3.12闭口系统经过一热力过程,工质由状态膨胀到状态2,过程中系统吸收热量70 kJ,对外做45 kJ。若将工质由不同的路径从状态2压缩到状1,外界对系统做功为50 kJ,则工质与外界的热量交是多少?
3.12闭口系统经过一热力过程,工质由状态膨胀到状态2,过程中系统吸收热量70 kJ,对外做45 kJ。若将工质由不同的路径从状态2压缩到状1,外界对系统做功为50 kJ,则工质与外界的热量交是多少?
题目解答
答案
根据热力学第一定律,系统的能量变化可以用以下公式表示:
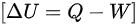
过程 1:从状态 1 到状态 2
已知条件:
吸收热量 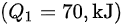
对外做功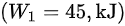
计算内能变化:
代入公式得:
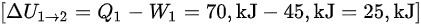
过程 2:从状态 2 压缩到状态 1
已知条件:
外界对系统做功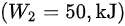
记住在压缩过程中,系统对外做功为负:
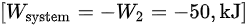
计算工质与外界的热量交换 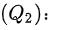
根据热力学第一定律:
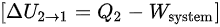
注意到内能变化是从状态 2 到状态 1,所以:
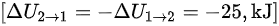
代入公式:
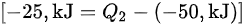
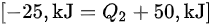
求解 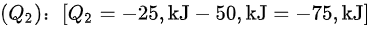
结论
因此,工质与外界的热量交换为:
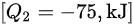
这表示工质向外界释放了 75 kJ 的热量。
解析
步骤 1:确定过程 1 的内能变化
根据热力学第一定律,系统的能量变化可以用以下公式表示:
$[ \Delta U=Q-W] $
其中,$\Delta U$ 是内能变化,$Q$ 是热量交换,$W$ 是功。
过程 1:从状态 1 到状态 2
已知条件:
吸收热量 $({Q}_{1}=70,{k}_{1}J)$
对外做功$({W}_{1}=45,{k}_{1}J)$
计算内能变化:
代入公式得:
$\Delta {U}_{1\rightarrow 2}={Q}_{1}-{W}_{1}=70$ kJ-45 ${K}_{1}=25,{K}_{2}J$
步骤 2:确定过程 2 的内能变化
过程 2:从状态 2 压缩到状态 1
已知条件:
外界对系统做功$({W}_{2}=50,{k}_{1}J)$
记住在压缩过程中,系统对外做功为负:
$[ {W}_{Sy}et=m{W}_{i}=-50,{k}_{1}J] $
计算工质与外界的热量交换 $({Q}_{2})$ :
根据热力学第一定律:
$[ \Delta {U}_{2\rightarrow 1}={Q}_{2}-{W}_{Sy}\quad \sec \quad 1$
注意到内能变化是从状态 2 到状态 1,所以:
[$\Delta {U}_{2-1}=-\Delta {[ 1}_{1}+2=-25,kJ] $
代入公式:
$[ -25,k] ={Q}_{2}-(-50,kJ)] $
$[ -25,k] ={Q}_{2}+50,kJ] $
求解 $({Q}_{2})$ :${Q}_{2}=-25$ kJ-50 $kJ=-75,kJJ$
根据热力学第一定律,系统的能量变化可以用以下公式表示:
$[ \Delta U=Q-W] $
其中,$\Delta U$ 是内能变化,$Q$ 是热量交换,$W$ 是功。
过程 1:从状态 1 到状态 2
已知条件:
吸收热量 $({Q}_{1}=70,{k}_{1}J)$
对外做功$({W}_{1}=45,{k}_{1}J)$
计算内能变化:
代入公式得:
$\Delta {U}_{1\rightarrow 2}={Q}_{1}-{W}_{1}=70$ kJ-45 ${K}_{1}=25,{K}_{2}J$
步骤 2:确定过程 2 的内能变化
过程 2:从状态 2 压缩到状态 1
已知条件:
外界对系统做功$({W}_{2}=50,{k}_{1}J)$
记住在压缩过程中,系统对外做功为负:
$[ {W}_{Sy}et=m{W}_{i}=-50,{k}_{1}J] $
计算工质与外界的热量交换 $({Q}_{2})$ :
根据热力学第一定律:
$[ \Delta {U}_{2\rightarrow 1}={Q}_{2}-{W}_{Sy}\quad \sec \quad 1$
注意到内能变化是从状态 2 到状态 1,所以:
[$\Delta {U}_{2-1}=-\Delta {[ 1}_{1}+2=-25,kJ] $
代入公式:
$[ -25,k] ={Q}_{2}-(-50,kJ)] $
$[ -25,k] ={Q}_{2}+50,kJ] $
求解 $({Q}_{2})$ :${Q}_{2}=-25$ kJ-50 $kJ=-75,kJJ$