题目
闭口系统经历一过程,其熵变化为25kJ/K,从300K热源吸热6000kJ,此过程是可逆、不可逆、不可能?
闭口系统经历一过程,其熵变化为25kJ/K,从300K热源吸热6000kJ,此过程是可逆、不可逆、不可能?
题目解答
答案
由闭口系统熵方程: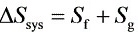
而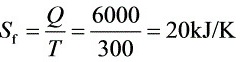
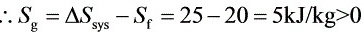
因此,此过程为不可逆过程。
解析
本题考查闭口系统熵方程以及根据熵产判断过程的性质。解题思路是先明确闭口系统熵方程,再分别计算出系统与热源交换热量引起的熵流和系统的熵变,最后通过熵方程求出熵产,根据熵产的正负来判断过程的性质。
- 明确闭口系统熵方程:
- 闭口系统熵方程为$\Delta S_{sys}=S_{f}+S_{g}$,其中$\Delta S_{sys}$是系统的熵变,$S_{f}$是熵流,$S_{g}$是熵产。
- 熵流$S_{f}$是由于系统与外界进行热量交换而引起的熵的变化,计算公式为$S_{f}=\frac{Q}{T}$,其中$Q$是系统与外界交换的热量,$T$是热源的温度。
- 熵产$S_{g}$表示过程的不可逆程度,对于可逆过程$S_{g} = 0$;对于不可逆过程$S_{g}>0$;对于不可能发生的过程$S_{g}<0$。
- 计算熵流$S_{f}$:
- 已知系统从$T = 300K$的热源吸热$Q = 6000kJ$,根据熵流计算公式$S_{f}=\frac{Q}{T}$,可得:
- $S_{f}=\frac{6000}{300}=20kJ/K$。
- 计算熵产$S_{g}$:
- 已知系统的熵变$\Delta S_{sys}=25kJ/K$,由闭口系统熵方程$\Delta S_{sys}=S_{f}+S_{g}$,可得$S_{g}=\Delta S_{sys}-S_{f}$。
- 将$\Delta S_{sys}=25kJ/K$,$S_{f}=20kJ/K$代入上式,可得$S_{g}=25 - 20 = 5kJ/K$。
- 判断过程的性质:
- 因为$S_{g}=5kJ/K>0$,所以此过程为不可逆过程。