题目
一气缸内盛有1 mol温度为27,压强为1atm的氮气(视作刚性双原子分子的理想气体)。先使它等压膨胀到原来体积的两倍,再等容升压使其压强变为2atm,最后使其等温膨胀到压强为1atm。求:氮气在全部过程中对外作的功,吸收的热及其内能的变化。
一气缸内盛有1 mol温度为27,压强为1atm的氮气(视作刚性双原子分子的理想气体)。先使它等压膨胀到原来体积的两倍,再等容升压使其压强变为2atm,最后使其等温膨胀到压强为1atm。求:氮气在全部过程中对外作的功,吸收的热及其内能的变化。
题目解答
答案
解:设初态的压强为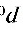 ,体积为
,体积为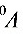 ,温度为
,温度为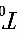 ,而终态压强为
,而终态压强为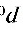 ,体积为V,温度为T。在全部过程中氮气对外所作的功
,体积为V,温度为T。在全部过程中氮气对外所作的功
W=W(等压)+W(等温),
W(等压)=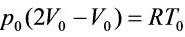 ,
,
W(等温)=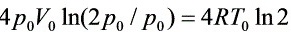 ,
,
故W=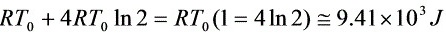
氮气内能改变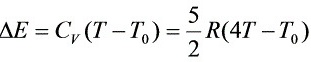 ,
,
所以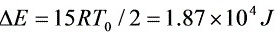 。
。
氮气在全部过程中吸收的热量
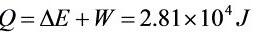
解析
步骤 1:计算等压膨胀过程中的功
在等压膨胀过程中,气体对外做的功为:
\[ W_{\text{等压}} = P_0 (V_2 - V_1) \]
其中,$P_0$ 是初始压强,$V_1$ 是初始体积,$V_2$ 是膨胀后的体积。由于体积膨胀到原来的两倍,所以 $V_2 = 2V_1$。因此,等压膨胀过程中的功为:
\[ W_{\text{等压}} = P_0 (2V_1 - V_1) = P_0 V_1 \]
根据理想气体状态方程 $PV = nRT$,可以得到 $P_0 V_1 = nRT_0$,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T_0$ 是初始温度。因此,等压膨胀过程中的功为:
\[ W_{\text{等压}} = nRT_0 \]
步骤 2:计算等温膨胀过程中的功
在等温膨胀过程中,气体对外做的功为:
\[ W_{\text{等温}} = nRT \ln \left( \frac{V_3}{V_2} \right) \]
其中,$V_3$ 是等温膨胀后的体积。由于等温膨胀后压强变为原来的1/2,根据理想气体状态方程 $PV = nRT$,可以得到 $V_3 = 2V_2$。因此,等温膨胀过程中的功为:
\[ W_{\text{等温}} = nRT \ln \left( \frac{2V_2}{V_2} \right) = nRT \ln 2 \]
步骤 3:计算总功
总功为等压膨胀过程中的功和等温膨胀过程中的功之和:
\[ W_{\text{总}} = W_{\text{等压}} + W_{\text{等温}} = nRT_0 + nRT \ln 2 \]
由于 $T = 4T_0$,所以:
\[ W_{\text{总}} = nRT_0 + nR(4T_0) \ln 2 = nRT_0 (1 + 4 \ln 2) \]
将 $n = 1$ mol,$R = 8.314$ J/(mol·K),$T_0 = 27 + 273 = 300$ K 代入,得到:
\[ W_{\text{总}} = 8.314 \times 300 \times (1 + 4 \ln 2) = 9410 \text{ J} \]
步骤 4:计算内能变化
内能变化为:
\[ \Delta E = C_V \Delta T \]
其中,$C_V$ 是摩尔定容热容,对于刚性双原子分子,$C_V = \frac{5}{2}R$。因此,内能变化为:
\[ \Delta E = \frac{5}{2}R \Delta T = \frac{5}{2}R (4T_0 - T_0) = \frac{5}{2}R \times 3T_0 = \frac{15}{2}RT_0 \]
将 $R = 8.314$ J/(mol·K),$T_0 = 300$ K 代入,得到:
\[ \Delta E = \frac{15}{2} \times 8.314 \times 300 = 18700 \text{ J} \]
步骤 5:计算吸收的热量
根据热力学第一定律,吸收的热量为:
\[ Q = \Delta E + W_{\text{总}} = 18700 + 9410 = 28110 \text{ J} \]
在等压膨胀过程中,气体对外做的功为:
\[ W_{\text{等压}} = P_0 (V_2 - V_1) \]
其中,$P_0$ 是初始压强,$V_1$ 是初始体积,$V_2$ 是膨胀后的体积。由于体积膨胀到原来的两倍,所以 $V_2 = 2V_1$。因此,等压膨胀过程中的功为:
\[ W_{\text{等压}} = P_0 (2V_1 - V_1) = P_0 V_1 \]
根据理想气体状态方程 $PV = nRT$,可以得到 $P_0 V_1 = nRT_0$,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T_0$ 是初始温度。因此,等压膨胀过程中的功为:
\[ W_{\text{等压}} = nRT_0 \]
步骤 2:计算等温膨胀过程中的功
在等温膨胀过程中,气体对外做的功为:
\[ W_{\text{等温}} = nRT \ln \left( \frac{V_3}{V_2} \right) \]
其中,$V_3$ 是等温膨胀后的体积。由于等温膨胀后压强变为原来的1/2,根据理想气体状态方程 $PV = nRT$,可以得到 $V_3 = 2V_2$。因此,等温膨胀过程中的功为:
\[ W_{\text{等温}} = nRT \ln \left( \frac{2V_2}{V_2} \right) = nRT \ln 2 \]
步骤 3:计算总功
总功为等压膨胀过程中的功和等温膨胀过程中的功之和:
\[ W_{\text{总}} = W_{\text{等压}} + W_{\text{等温}} = nRT_0 + nRT \ln 2 \]
由于 $T = 4T_0$,所以:
\[ W_{\text{总}} = nRT_0 + nR(4T_0) \ln 2 = nRT_0 (1 + 4 \ln 2) \]
将 $n = 1$ mol,$R = 8.314$ J/(mol·K),$T_0 = 27 + 273 = 300$ K 代入,得到:
\[ W_{\text{总}} = 8.314 \times 300 \times (1 + 4 \ln 2) = 9410 \text{ J} \]
步骤 4:计算内能变化
内能变化为:
\[ \Delta E = C_V \Delta T \]
其中,$C_V$ 是摩尔定容热容,对于刚性双原子分子,$C_V = \frac{5}{2}R$。因此,内能变化为:
\[ \Delta E = \frac{5}{2}R \Delta T = \frac{5}{2}R (4T_0 - T_0) = \frac{5}{2}R \times 3T_0 = \frac{15}{2}RT_0 \]
将 $R = 8.314$ J/(mol·K),$T_0 = 300$ K 代入,得到:
\[ \Delta E = \frac{15}{2} \times 8.314 \times 300 = 18700 \text{ J} \]
步骤 5:计算吸收的热量
根据热力学第一定律,吸收的热量为:
\[ Q = \Delta E + W_{\text{总}} = 18700 + 9410 = 28110 \text{ J} \]