题目
1mol单原子理想气体,从300K等体加热至500K,则吸收热量为__________J,内能增量为_________,对外做功_________J.
1mol单原子理想气体,从300K等体加热至500K,则吸收热量为__________J,内能增量为_________,对外做功_________J.
题目解答
答案
1. 吸收热量的计算:
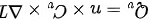
其中,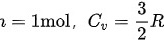 ,
,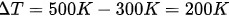
代入给定值和已知的气体常数 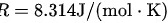 :
:
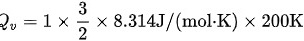
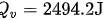
2. 内能增量的计算:
由于在等体条件下,气体所吸收的热量 等于其内能 U的变化,因此:
等于其内能 U的变化,因此:
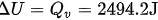
3. 对外做功的计算:
在等体过程中,气体的体积保持不变,所以气体不对外做功。因此:
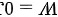
综上,1 mol单原子理想气体从300K等体加热至500K,吸收热量为 2494.2 J,内能增量为 2494.2 J,对外做功为 0 J。
解析
考查要点:本题主要考查理想气体在等体过程中的热力学量计算,包括吸收热量、内能变化和对外做功。
解题核心思路:
- 等体过程中,体积不变,气体对外做功为零($W=0$)。
- 根据热力学第一定律,吸收的热量等于内能的增量($Q = \Delta U$)。
- 单原子理想气体的定容比热容为 $C_V = \frac{3}{2}R$,内能变化公式为 $\Delta U = n C_V \Delta T$。
破题关键点:
- 明确等体过程的特点($W=0$,$Q=\Delta U$)。
- 正确代入单原子气体的比热容和气体常数 $R=8.314 \, \text{J/(mol·K)}$。
1. 吸收热量的计算
公式:
$Q_V = n C_V \Delta T$
代入数据:
- $n = 1 \, \text{mol}$
- $C_V = \frac{3}{2}R = \frac{3}{2} \times 8.314 \, \text{J/(mol·K)}$
- $\Delta T = 500 \, \text{K} - 300 \, \text{K} = 200 \, \text{K}$
计算:
$Q_V = 1 \times \frac{3}{2} \times 8.314 \times 200 = 2494.2 \, \text{J}$
2. 内能增量的计算
在等体过程中,吸收的热量全部转化为内能,因此:
$\Delta U = Q_V = 2494.2 \, \text{J}$
3. 对外做功的计算
等体过程中体积不变,对外做功为零:
$W = 0 \, \text{J}$