题目
2-2 对于氢原子、一次电离的氦离子 (e)^+ 和两次电离的锂离子 ^+, 分别计算它们-|||-的:-|||-(1)第一、第二玻尔轨道半径及电子在这些轨道上的速度;(2)电子在基态的结合能;-|||-(3)由基态到第一激发态所需的激发能量及由第一激发态退激到基态所放光子的波长.

题目解答
答案
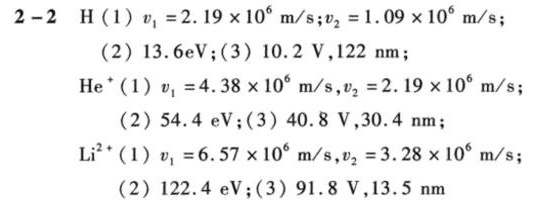
解析
步骤 1:计算玻尔轨道半径
玻尔轨道半径公式为:${r}_{n} = n^2 \times a_0$,其中 $n$ 是主量子数,$a_0$ 是玻尔半径,对于氢原子 $a_0 = 5.29 \times 10^{-11} m$。对于 ${He}^{+}$ 和 ${Li}^{2+}$,玻尔半径公式变为 ${r}_{n} = n^2 \times a_0 / Z$,其中 $Z$ 是原子核的电荷数。
步骤 2:计算电子速度
电子在玻尔轨道上的速度公式为:${v}_{n} = \frac{Z \times e^2}{2 \times \epsilon_0 \times h \times n}$,其中 $e$ 是电子电荷,$\epsilon_0$ 是真空介电常数,$h$ 是普朗克常数。
步骤 3:计算结合能
电子在基态的结合能公式为:$E = -\frac{Z^2 \times e^4 \times m_e}{8 \times \epsilon_0^2 \times h^2}$,其中 $m_e$ 是电子质量。
步骤 4:计算激发能量和波长
激发能量公式为:$\Delta E = E_{n=2} - E_{n=1}$,其中 $E_{n=2}$ 和 $E_{n=1}$ 分别是第二和第一玻尔轨道的能量。波长公式为:$\lambda = \frac{hc}{\Delta E}$,其中 $c$ 是光速。
玻尔轨道半径公式为:${r}_{n} = n^2 \times a_0$,其中 $n$ 是主量子数,$a_0$ 是玻尔半径,对于氢原子 $a_0 = 5.29 \times 10^{-11} m$。对于 ${He}^{+}$ 和 ${Li}^{2+}$,玻尔半径公式变为 ${r}_{n} = n^2 \times a_0 / Z$,其中 $Z$ 是原子核的电荷数。
步骤 2:计算电子速度
电子在玻尔轨道上的速度公式为:${v}_{n} = \frac{Z \times e^2}{2 \times \epsilon_0 \times h \times n}$,其中 $e$ 是电子电荷,$\epsilon_0$ 是真空介电常数,$h$ 是普朗克常数。
步骤 3:计算结合能
电子在基态的结合能公式为:$E = -\frac{Z^2 \times e^4 \times m_e}{8 \times \epsilon_0^2 \times h^2}$,其中 $m_e$ 是电子质量。
步骤 4:计算激发能量和波长
激发能量公式为:$\Delta E = E_{n=2} - E_{n=1}$,其中 $E_{n=2}$ 和 $E_{n=1}$ 分别是第二和第一玻尔轨道的能量。波长公式为:$\lambda = \frac{hc}{\Delta E}$,其中 $c$ 是光速。