题目
理想气体内能增量Delta E=dfrac (m)(M)dfrac (i)(2)RDelta T,由于Delta E=dfrac (m)(M)dfrac (i)(2)RDelta T,故Delta E=dfrac (m)(M)dfrac (i)(2)RDelta T,该方程适用于Delta E=dfrac (m)(M)dfrac (i)(2)RDelta TDelta E=dfrac (m)(M)dfrac (i)(2)RDelta T等体过程; Delta E=dfrac (m)(M)dfrac (i)(2)RDelta T等压过程;Delta E=dfrac (m)(M)dfrac (i)(2)RDelta T绝热过程; Delta E=dfrac (m)(M)dfrac (i)(2)RDelta T任何过程
理想气体内能增量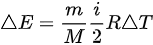 ,由于
,由于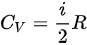 ,故
,故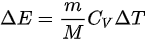 ,该方程适用于
,该方程适用于
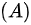 等体过程;
等体过程; 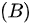 等压过程;
等压过程;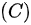 绝热过程;
绝热过程; 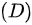 任何过程
任何过程
题目解答
答案
根据该方程,我们可以得出以下结论:
- 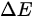 与质量m成正比,表示质量越大,内能增量越大。
与质量m成正比,表示质量越大,内能增量越大。
- 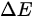 与摩尔质量M成反比,表示摩尔质量越小,内能增量越大。
与摩尔质量M成反比,表示摩尔质量越小,内能增量越大。
- 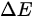 与自由度数i成正比,表示自由度数越大,内能增量越大。
与自由度数i成正比,表示自由度数越大,内能增量越大。
- 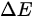 与温度变化量
与温度变化量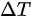 成正比,表示温度变化量越大,内能增量越大。
成正比,表示温度变化量越大,内能增量越大。
根据上述结论,我们可以得出以下答案:
该方程适用于任何过程,因为无论是等体过程、等压过程还是绝热过程,都可以通过调整质量m、摩尔质量M、自由度数i和温度变化量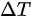 来满足该方程。因此,选项
来满足该方程。因此,选项 任何过程是正确的答案。
任何过程是正确的答案。
具体过程如下:
- 对于等体过程,体积不变,即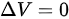 。根据理想气体状态方程
。根据理想气体状态方程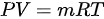 ,可以得到
,可以得到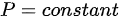 ,即压强不变。由于等体过程中压强不变,
,即压强不变。由于等体过程中压强不变,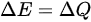 ,即内能增量等于热量的增量。因此,可以将
,即内能增量等于热量的增量。因此,可以将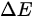 表示为
表示为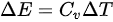 ,其中
,其中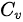 为等体过程的定压热容量。
为等体过程的定压热容量。
- 对于等压过程,压强不变,即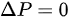 。根据理想气体状态方程
。根据理想气体状态方程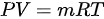 ,可以得到
,可以得到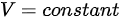 ,即体积不变。由于等压过程中体积不变,
,即体积不变。由于等压过程中体积不变,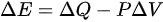 ,即内能增量等于热量的增量减去对外做功。因此,可以将
,即内能增量等于热量的增量减去对外做功。因此,可以将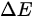 表示为
表示为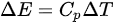 ,其中
,其中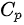 为等压过程的定压热容量。
为等压过程的定压热容量。
- 对于绝热过程,没有热量的交换,即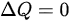 。根据绝热过程的定义,可以得到
。根据绝热过程的定义,可以得到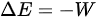 ,即内能增量等于对外做功的负值。因此,可以将
,即内能增量等于对外做功的负值。因此,可以将 表示为
表示为 ,即绝热过程中内能不发生变化。
,即绝热过程中内能不发生变化。
综上所述,该方程适用于任何过程。
解析
考查要点:本题主要考查理想气体内能变化公式的适用条件,以及对热力学过程中内能变化本质的理解。
解题核心思路:
- 内能是状态函数,其变化仅由温度变化决定,与过程无关。
- 公式 $\Delta E = \dfrac{m}{M}C_V \Delta T$ 中,$C_V$ 是定容摩尔热容,但 内能变化的计算与过程类型无关,只需温度变化 $\Delta T$。
- 无论等体、等压还是绝热过程,只要温度变化,内能变化均可通过该公式计算。
破题关键点:
- 明确内能是温度的函数,与过程路径无关。
- 区分热量传递(与过程相关)和内能变化(与状态相关)。
公式本质分析
理想气体内能公式 $\Delta E = \dfrac{m}{M}C_V \Delta T$ 中:
- $\dfrac{m}{M}$ 是物质的量 $n$,$C_V$ 是定容摩尔热容,$\Delta T$ 是温度变化。
- 内能变化仅由温度变化决定,与过程是否做功或吸热无关。
各过程适用性分析
-
等体过程:
- 体积不变,无做功,$\Delta E = Q_V = C_V \Delta T$。
- 公式直接适用。
-
等压过程:
- 气体对外做功,$\Delta E = C_V \Delta T$,但吸收的热量 $Q_P = C_P \Delta T$ 包含做功部分。
- 内能变化仍由 $\Delta T$ 决定,公式成立。
-
绝热过程:
- 无热量交换,$\Delta E = -W$(做功的负值),但温度仍变化。
- 只要 $\Delta T \neq 0$,公式仍适用。
结论:无论过程类型,只要温度变化,公式均成立,因此适用于任何过程。