一定量的某单原子分子理想气体装在封闭的汽缸里。此汽缸有可活动的活塞(活塞与气缸壁之间无摩擦且无漏气)。已知气体的初压强p_1=1rm(atm),体积V_1=1L,现将该气体在等压下加热直到体积为原来的两倍,然后在等体积下加热直到压强为原来的2倍,最后作绝热膨胀,直到温度下降到初温为止。(1)在p-V图上将整个过程表示出来;(2)试求在整个过程中气体内能的改变;(3)试求在整个过程中气体所吸收的热量;(4)试求在整个过程中气体所作的功。
一定量的某单原子分子理想气体装在封闭的汽缸里。此汽缸有可活动的活塞(活塞与气缸壁之间无摩擦且无漏气)。已知气体的初压强$$p_1=1\rm{atm}$$,体积$$V_1$$$$=1L$$,现将该气体在等压下加热直到体积为原来的两倍,然后在等体积下加热直到压强为原来的2倍,最后作绝热膨胀,直到温度下降到初温为止。
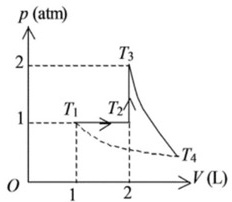
(1)在$$p-V$$图上将整个过程表示出来;
(2)试求在整个过程中气体内能的改变;
(3)试求在整个过程中气体所吸收的热量;
(4)试求在整个过程中气体所作的功。
题目解答
答案
(1)
(2) $$0$$
(3) $$5.6\times 10{}^{2} J$$
(4) $$5.6\times 10{}^{2} J$$
解析
本题考查理想气体的热力学过程,涉及等压、等容、绝热过程的综合应用。核心思路是分阶段分析各过程的内能变化、做功和吸热,再整体求和。关键点包括:
- 单原子气体的比热容:$C_v = \frac{3}{2}R$,$C_p = \frac{5}{2}R$;
- 状态方程:$PV = nRT$;
- 绝热过程关系:$TV^{\gamma-1} = \text{常数}$,其中$\gamma = \frac{5}{3}$;
- 热力学第一定律:$\Delta U = Q - W$($W$为气体对外做功)。
(2) 内能的改变
单原子气体的内能仅由温度决定。整个过程最终温度回到初始值,因此$\Delta U = 0$。
(3) 吸收的热量
分三段计算:
-
等压膨胀(1→2):
体积变为$2L$,温度升至$2T_1$。
吸收热量:
$Q_1 = nC_p\Delta T = n\frac{5}{2}R(T_2 - T_1) = \frac{5}{2}nRT_1.$ -
等容加热(2→3):
压强升至$2\text{atm}$,温度升至$4T_1$。
吸收热量:
$Q_2 = nC_v\Delta T = n\frac{3}{2}R(T_3 - T_2) = 3nRT_1.$ -
绝热膨胀(3→4):
无热量交换,$Q_3 = 0$。
总热量:
$Q_{\text{总}} = Q_1 + Q_2 = \frac{11}{2}nRT_1.$
(4) 气体所做的功
分三段计算:
-
等压膨胀(1→2):
$W_1 = P_1\Delta V = 1\text{atm} \cdot 1\text{L} = 101.325\text{J}.$ -
等容加热(2→3):
$W_2 = 0.$ -
绝热膨胀(3→4):
温度从$4T_1$降至$T_1$,根据$\Delta U = -W$:
$W_3 = -\Delta U = \frac{9}{2}nRT_1.$
总功:
$W_{\text{总}} = W_1 + W_3 = 101.325\text{J} + \frac{9}{2}nRT_1.$
联立热力学第一定律:
$\Delta U = Q_{\text{总}} - W_{\text{总}} = 0 \implies \frac{11}{2}nRT_1 = 101.325\text{J} + \frac{9}{2}nRT_1,$
解得$nRT_1 = 101.325\text{J}$,代入得:
$Q_{\text{总}} = W_{\text{总}} = 5.6 \times 10^2\text{J}.$