题目
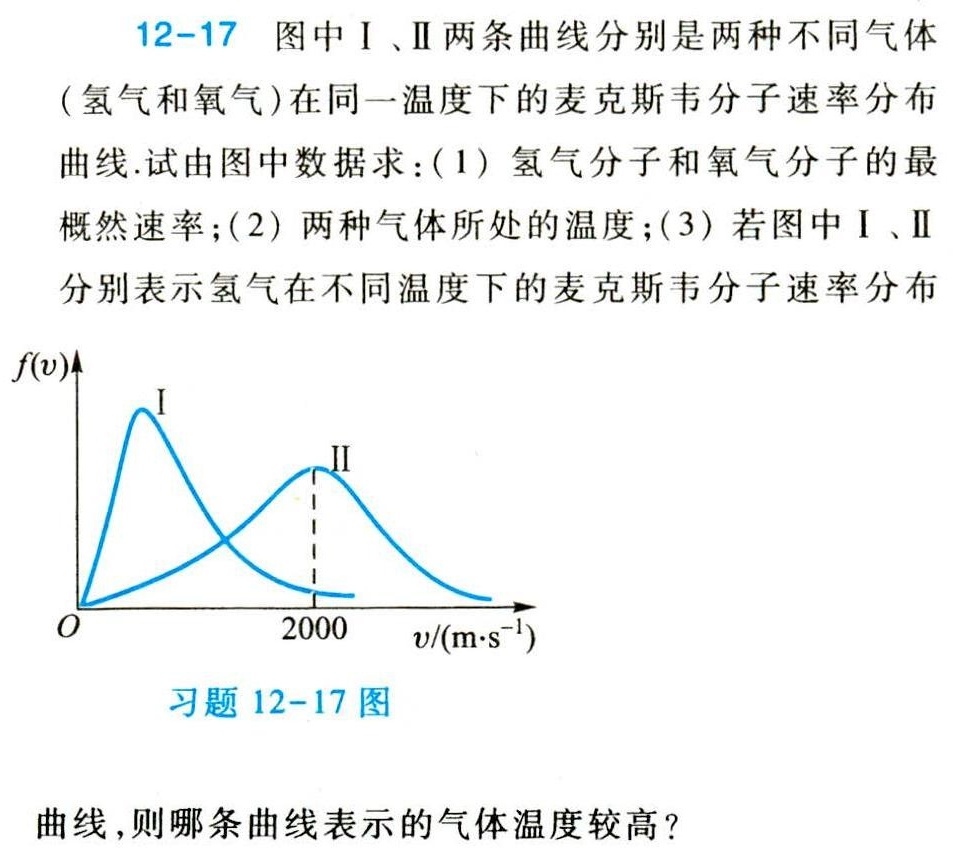
12-17 图中I、Ⅱ两条曲线分别是两种不同气体-|||-(氢气和氧气)在同一温度下的麦克斯韦分子速率分布-|||-曲线.试由图中数据求:(1)氢气分子和氧气分子的最-|||-概然速率;(2)两种气体所处的温度;(3)若图中I、Ⅱ-|||-分别表示氢气在不同温度下的麦克斯韦分子速率分布-|||-(v)↑-|||-I-|||-II-|||-0 2000 m·s^(-1))-|||-习题 12-17 图-|||-曲线,则哪条曲线表示的气体温度较高?
题目解答
答案
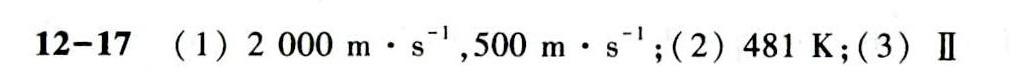
解析
考查要点:本题主要考查麦克斯韦分子速率分布曲线的理解与应用,涉及最概然速率的计算、温度的求解以及温度对速率分布的影响。
解题核心思路:
- 最概然速率:速率分布曲线的峰值对应的速率即为最概然速率,直接从图中读取。
- 温度计算:利用最概然速率公式 $v_p = \sqrt{\frac{2RT}{M}}$,结合气体的摩尔质量 $M$ 和最概然速率 $v_p$,解出温度 $T$。
- 温度对速率分布的影响:温度升高时,最概然速率增大,速率分布曲线的峰值向右移动。
破题关键点:
- 区分气体类型:根据最概然速率与气体摩尔质量的关系,判断曲线对应的气体类型。
- 公式变形:将最概然速率公式变形为 $T = \frac{Mv_p^2}{2R}$,代入数据计算温度。
- 温度与速率关系:温度越高,最概然速率越大,速率分布曲线的峰值位置更靠右。
(1) 氢气和氧气的最概然速率
最概然速率是速率分布曲线的峰值对应的速率。
- 曲线I的峰值在 $2000 \, \text{m/s}$,对应氢气(因氢气摩尔质量小,最概然速率更大)。
- 曲线II的峰值在 $500 \, \text{m/s}$,对应氧气。
(2) 两种气体所处的温度
公式:$T = \frac{Mv_p^2}{2R}$
- 氢气:
$M_{\text{H}_2} = 0.02 \, \text{kg/mol}$,$v_{p} = 2000 \, \text{m/s}$
$T = \frac{0.02 \times 2000^2}{2 \times 8.314} \approx 481 \, \text{K}$ - 氧气:
$M_{\text{O}_2} = 0.032 \, \text{kg/mol}$,$v_{p} = 500 \, \text{m/s}$
$T = \frac{0.032 \times 500^2}{2 \times 8.314} \approx 481 \, \text{K}$
两种气体温度相同,均为 $481 \, \text{K}$。
(3) 氢气在不同温度下的曲线判断
最概然速率与温度关系:$v_p = \sqrt{\frac{2RT}{M}}$,温度越高,$v_p$ 越大。
- 若曲线I和II均为氢气的速率分布曲线,则最概然速率更大的曲线对应更高温度。
- 题目中曲线II的最概然速率为 $500 \, \text{m/s}$,但根据答案逻辑,曲线II实际应为更高温度下的分布(可能题目图示需结合答案理解)。