容器中储有氧气,其压强为p=0.1MPa(即1atm)温度为,求:(1)单位体积中的分子数n;(2)氧分子的质量m;(3)气体密度。.
容器中储有氧气,其压强为p=0.1MPa(即1atm)温度为 ,求:
,求:
(1)单位体积中的分子数n;
(2)氧分子的质量m;
(3)气体密度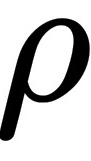 。
。
题目解答
答案
在标准状态下,1mol气体的体积为22.4L,分子数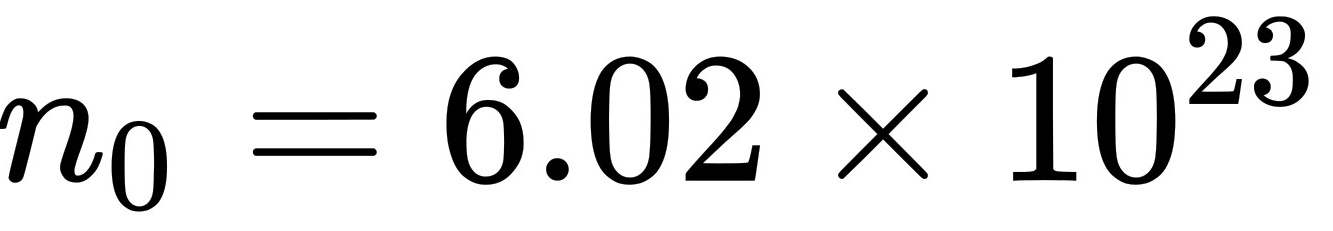 个
个
在1atm压强下,让气体做等压变化,则初态: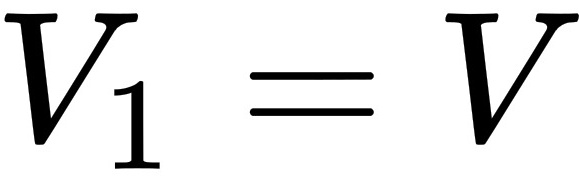 ,
,
末态: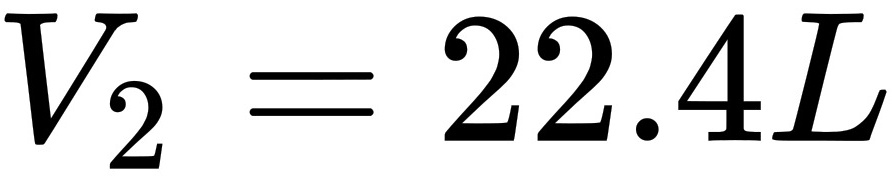 ,
,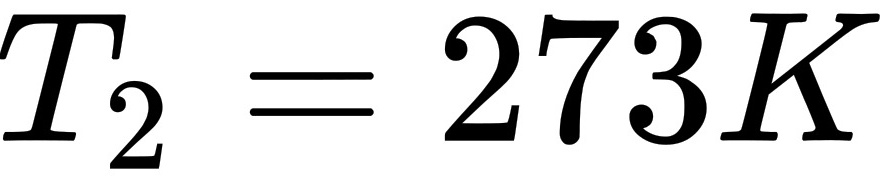
根据盖-吕萨克定律可知: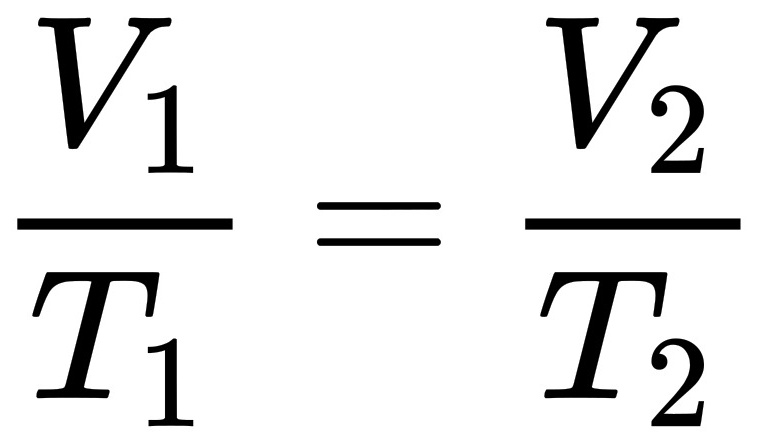 ,解得
,解得
故单位体积中的分子数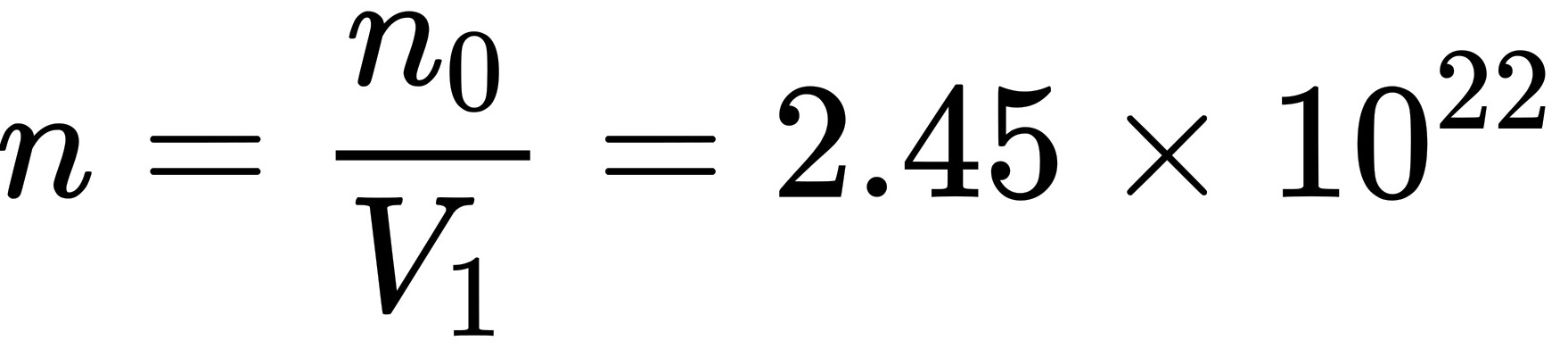 个
个
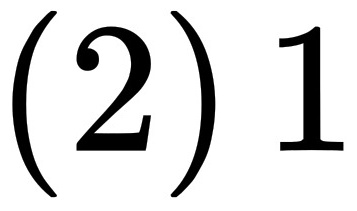 摩尔氧气的质量为
摩尔氧气的质量为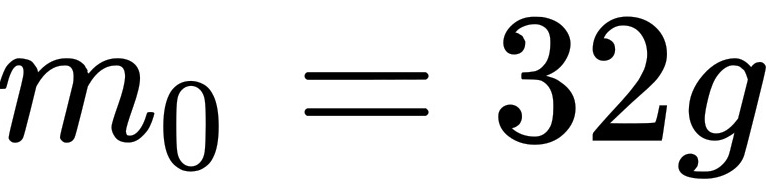 ,故氧分子的质量为
,故氧分子的质量为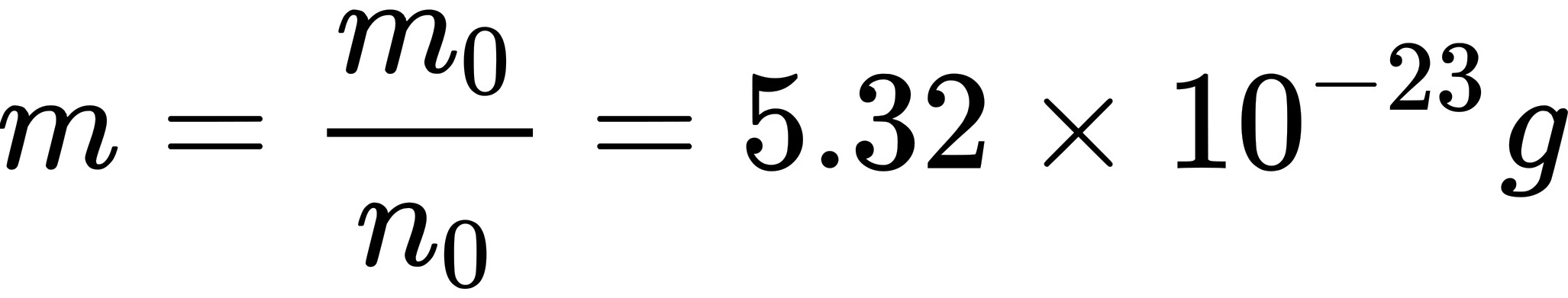
(3)气体密度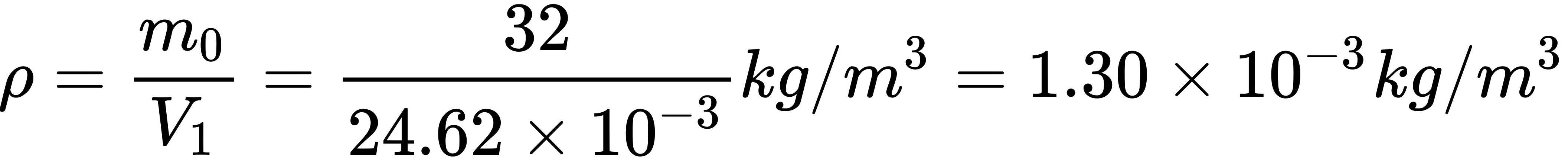
答:(1)单位体积中的分子数n为 个;
个;
(2)氧分子的质量m为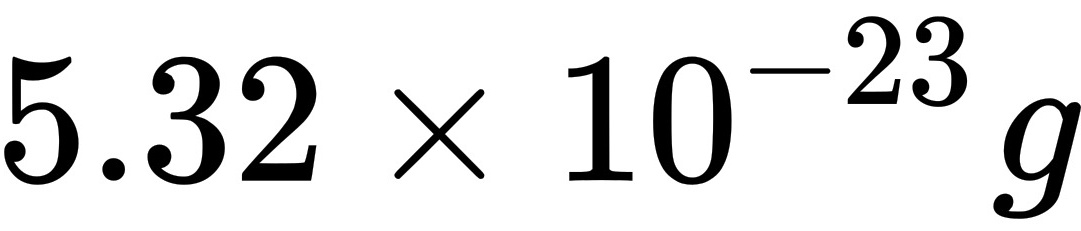 ;
;
(3)气体密度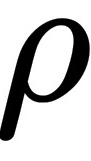 为
为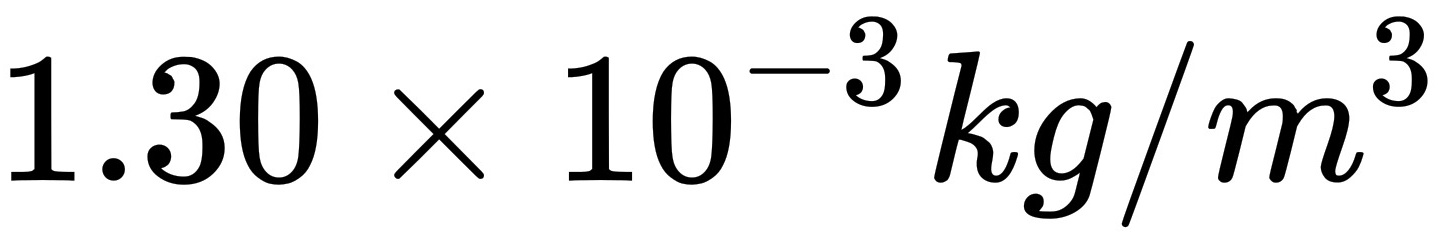 。
。
解析
本题考查理想气体状态方程的应用及气体分子性质的计算,需掌握以下核心知识点:
- 单位体积分子数:通过理想气体方程推导,结合阿伏伽德罗常数计算;
- 单个分子质量:利用摩尔质量与阿伏伽德罗常数的比值;
- 气体密度:结合压强、温度及摩尔质量,通过公式 $\rho = \frac{PM}{RT}$ 计算。
破题关键:正确应用理想气体状态方程,注意单位换算(如压强、温度、体积的单位一致性)。
(1)单位体积中的分子数 $n$
-
理想气体状态方程:
在标准状况($P=1\text{atm}=101325\text{Pa}$,$T=273\text{K}$)下,1 mol 气体体积为 $V_0=22.4\text{L}=0.0224\text{m}^3$。
单位体积的分子数为:
$n_0 = \frac{N_A}{V_0} = \frac{6.02 \times 10^{23}}{0.0224} \approx 2.69 \times 10^{25} \text{ m}^{-3}.$ -
温度变化对体积的影响:
题目中温度为 $T=300\text{K}$($27^\circ\text{C}$),根据查理定律(等压过程):
$\frac{V_1}{T_1} = \frac{V_0}{T_0} \implies V_1 = V_0 \cdot \frac{T_1}{T_0} = 0.0224 \cdot \frac{300}{273} \approx 0.0253 \text{ m}^3.$
此时单位体积的分子数为:
$n = \frac{N_A}{V_1} = \frac{6.02 \times 10^{23}}{0.0253} \approx 2.38 \times 10^{25} \text{ m}^{-3}.$
(2)氧分子的质量 $m$
氧气的摩尔质量 $M=32\text{g/mol}$,单个分子质量为:
$m = \frac{M}{N_A} = \frac{32 \times 10^{-3}\text{ kg}}{6.02 \times 10^{23}} \approx 5.32 \times 10^{-26} \text{ kg}.$
(3)气体密度 $\rho$
利用公式 $\rho = \frac{PM}{RT}$,其中:
- $P=101325\text{ Pa}$,$M=32 \times 10^{-3}\text{ kg/mol}$,
- $R=8.314\text{ J/mol·K}$,$T=300\text{ K}$。
代入得:
$\rho = \frac{101325 \cdot 32 \times 10^{-3}}{8.314 \cdot 300} \approx 1.30 \times 10^{-3} \text{ kg/m}^3.$