题目
1 mol单原子分子理想气体的循环过程如T-V所示,其中c点的温度为Tc=600 K。试求: (1) ab、bc、ca各个过程系统吸收的热量;(2) 经一循环系统所作的净功;(3) 循环的效率。(注:ln2=0.693)
1 mol单原子分子理想气体的循环过程如T-V所示,其中c点的温度为Tc=600 K。试求:
(1) ab、bc、ca各个过程系统吸收的热量;
(2) 经一循环系统所作的净功;
(3) 循环的效率。
(注:ln2=0.693)
题目解答
答案
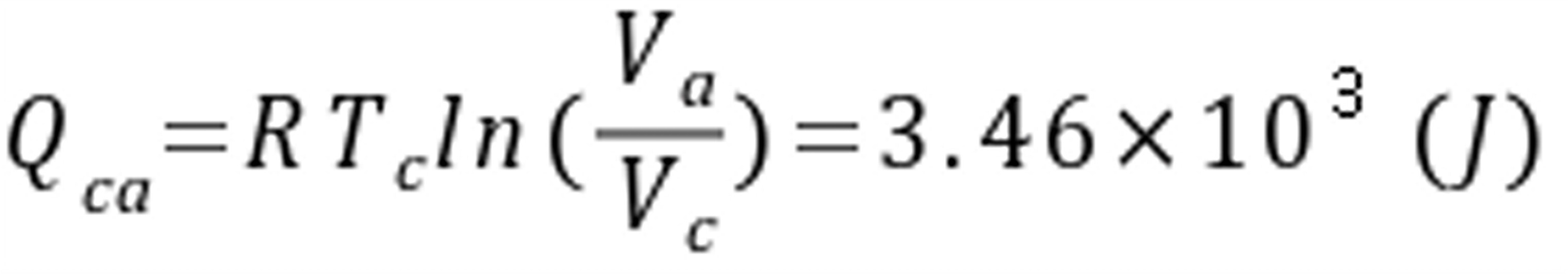 ﻩ(吸热)
ﻩ(吸热)(2) 循环系统所作的净功 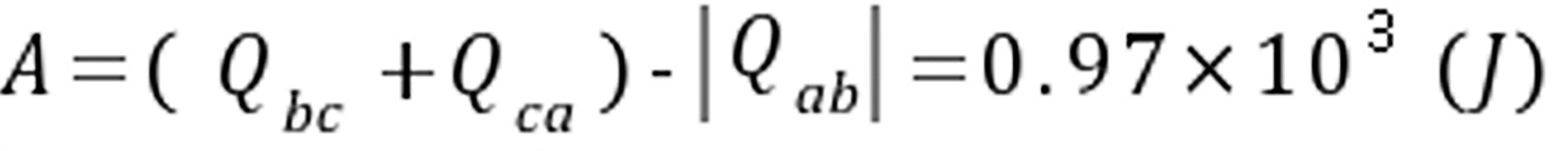
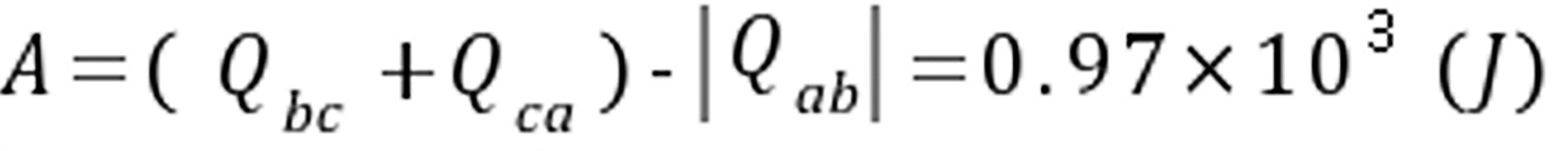
(3) 循环系统吸收的总热量 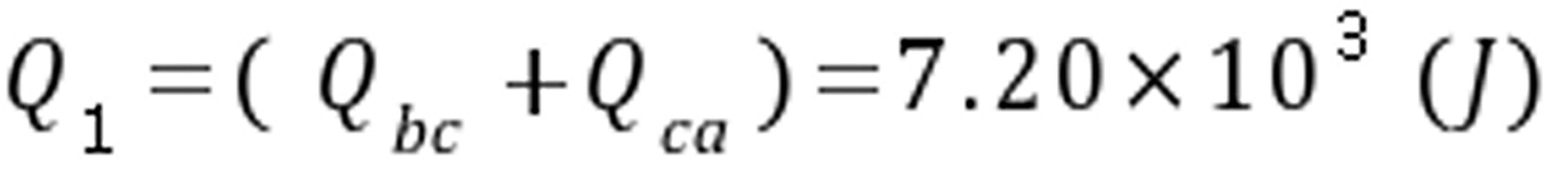
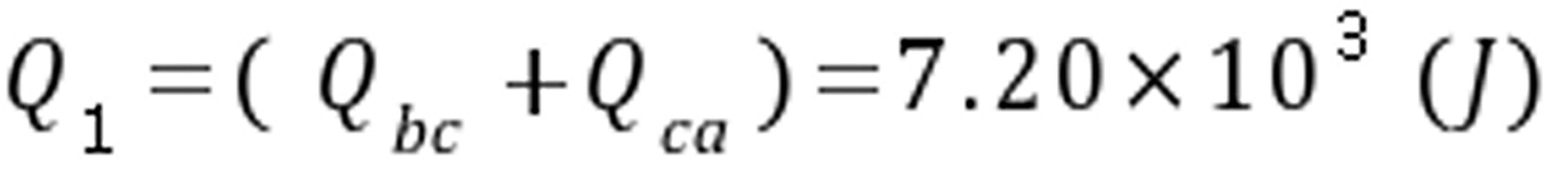
循环的效率ﻩﻩﻩﻩ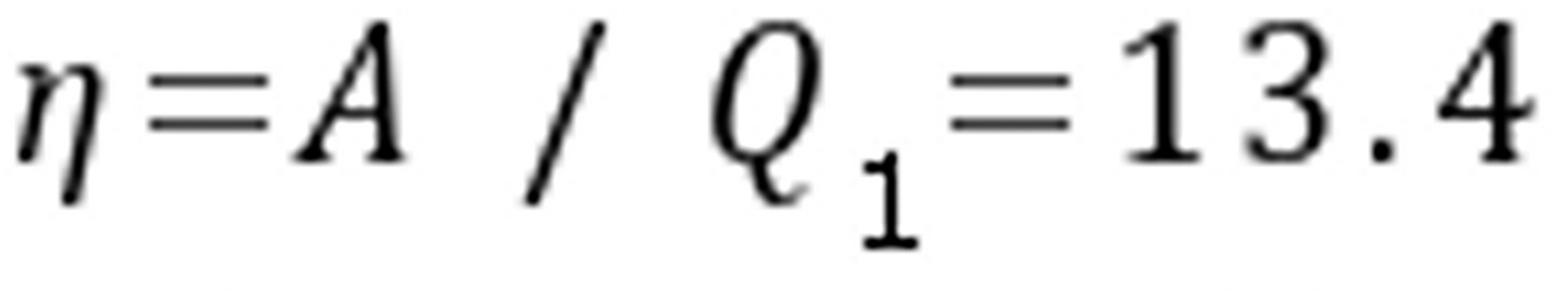
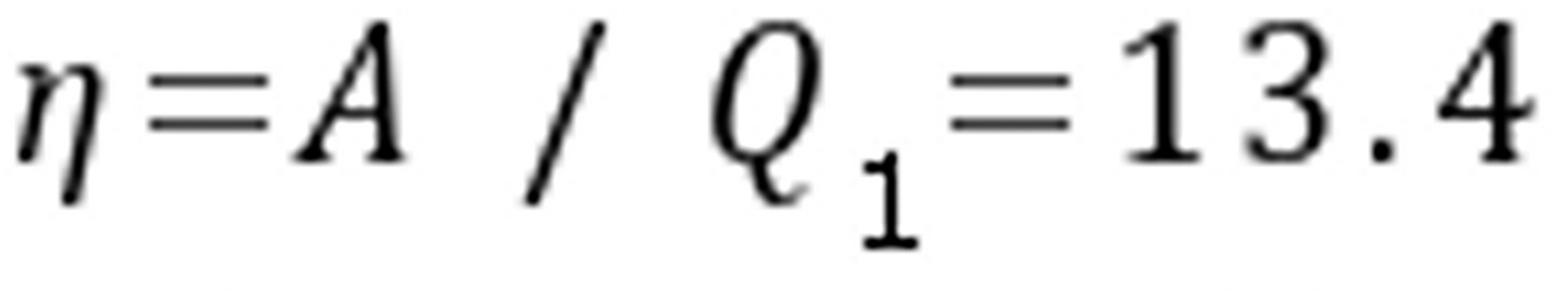
解析
步骤 1:计算ab过程系统吸收的热量
根据理想气体状态方程PV=nRT,以及等压过程的热量计算公式Q=nCpΔT,其中Cp是定压摩尔热容,对于单原子理想气体,Cp=5R/2。因此,ab过程的热量为:
${Q}_{ab}=n{C}_{p}\Delta T=n\frac{5}{2}R\Delta T$
步骤 2:计算bc过程系统吸收的热量
bc过程是等体过程,根据等体过程的热量计算公式Q=nCvΔT,其中Cv是定容摩尔热容,对于单原子理想气体,Cv=3R/2。因此,bc过程的热量为:
${Q}_{bc}=n{C}_{v}\Delta T=n\frac{3}{2}R\Delta T$
步骤 3:计算ca过程系统吸收的热量
ca过程是等温过程,根据等温过程的热量计算公式Q=nRTln(V2/V1),其中V2和V1分别是过程结束和开始时的体积。因此,ca过程的热量为:
${Q}_{ca}=nRT\ln (\frac{{V}_{a}}{{V}_{c}})$
步骤 4:计算循环系统所作的净功
循环系统所作的净功等于循环过程中系统吸收的总热量减去系统对外做的功。根据热力学第一定律,系统吸收的总热量等于系统对外做的功加上系统内能的增加。因此,循环系统所作的净功为:
$A={Q}_{bc}+{Q}_{ca}-{Q}_{ab}$
步骤 5:计算循环的效率
循环的效率定义为循环系统所作的净功与循环系统吸收的总热量之比。因此,循环的效率为:
$n=\frac{A}{{Q}_{1}}$
根据理想气体状态方程PV=nRT,以及等压过程的热量计算公式Q=nCpΔT,其中Cp是定压摩尔热容,对于单原子理想气体,Cp=5R/2。因此,ab过程的热量为:
${Q}_{ab}=n{C}_{p}\Delta T=n\frac{5}{2}R\Delta T$
步骤 2:计算bc过程系统吸收的热量
bc过程是等体过程,根据等体过程的热量计算公式Q=nCvΔT,其中Cv是定容摩尔热容,对于单原子理想气体,Cv=3R/2。因此,bc过程的热量为:
${Q}_{bc}=n{C}_{v}\Delta T=n\frac{3}{2}R\Delta T$
步骤 3:计算ca过程系统吸收的热量
ca过程是等温过程,根据等温过程的热量计算公式Q=nRTln(V2/V1),其中V2和V1分别是过程结束和开始时的体积。因此,ca过程的热量为:
${Q}_{ca}=nRT\ln (\frac{{V}_{a}}{{V}_{c}})$
步骤 4:计算循环系统所作的净功
循环系统所作的净功等于循环过程中系统吸收的总热量减去系统对外做的功。根据热力学第一定律,系统吸收的总热量等于系统对外做的功加上系统内能的增加。因此,循环系统所作的净功为:
$A={Q}_{bc}+{Q}_{ca}-{Q}_{ab}$
步骤 5:计算循环的效率
循环的效率定义为循环系统所作的净功与循环系统吸收的总热量之比。因此,循环的效率为:
$n=\frac{A}{{Q}_{1}}$