题目
6.常温常压下,一定量的某种理想气体(可视为刚性分子,自由度为i),在等压-|||-过程中吸热为Q,对外做功为A,内能增加为 △E, 则 A/Q= __ Delta E/Q=-|||-__ o

题目解答
答案
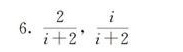
解析
步骤 1:理解等压过程中的热力学关系
在等压过程中,理想气体的内能变化 $\Delta E$ 与温度变化 $\Delta T$ 之间的关系为 $\Delta E = \frac {i}{2} n R \Delta T$,其中 $i$ 是分子的自由度,$n$ 是摩尔数,$R$ 是理想气体常数。同时,根据热力学第一定律,吸热 $Q$ 等于内能增加 $\Delta E$ 加上对外做的功 $A$,即 $Q = \Delta E + A$。
步骤 2:计算对外做功与吸热的比值
在等压过程中,对外做的功 $A$ 可以表示为 $A = n R \Delta T$。因此,对外做功与吸热的比值为 $A/Q = \frac {n R \Delta T}{\Delta E + A} = \frac {n R \Delta T}{\frac {i}{2} n R \Delta T + n R \Delta T} = \frac {2}{i+2}$。
步骤 3:计算内能增加与吸热的比值
内能增加与吸热的比值为 $\Delta E/Q = \frac {\Delta E}{\Delta E + A} = \frac {\frac {i}{2} n R \Delta T}{\frac {i}{2} n R \Delta T + n R \Delta T} = \frac {i}{i+2}$。
在等压过程中,理想气体的内能变化 $\Delta E$ 与温度变化 $\Delta T$ 之间的关系为 $\Delta E = \frac {i}{2} n R \Delta T$,其中 $i$ 是分子的自由度,$n$ 是摩尔数,$R$ 是理想气体常数。同时,根据热力学第一定律,吸热 $Q$ 等于内能增加 $\Delta E$ 加上对外做的功 $A$,即 $Q = \Delta E + A$。
步骤 2:计算对外做功与吸热的比值
在等压过程中,对外做的功 $A$ 可以表示为 $A = n R \Delta T$。因此,对外做功与吸热的比值为 $A/Q = \frac {n R \Delta T}{\Delta E + A} = \frac {n R \Delta T}{\frac {i}{2} n R \Delta T + n R \Delta T} = \frac {2}{i+2}$。
步骤 3:计算内能增加与吸热的比值
内能增加与吸热的比值为 $\Delta E/Q = \frac {\Delta E}{\Delta E + A} = \frac {\frac {i}{2} n R \Delta T}{\frac {i}{2} n R \Delta T + n R \Delta T} = \frac {i}{i+2}$。