题目
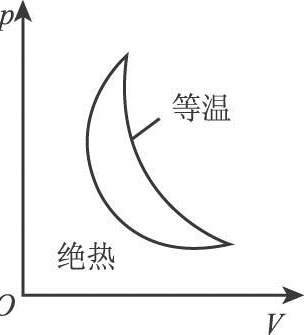
假设某一循环由等温过程和绝热过程组成(如图所示),可以认为( )等温-|||-绝热A.此循环过程违反热力学第一定律,但不违反热力学第二定律B.此循环过程违反热力学第二定律,但不违反热力学第一定律C.此循环过程既违反热力学第一定律,也违反热力学第二定律D.此循环过程既不违反热力学第一定律,也不违反热力学第二定律
假设某一循环由等温过程和绝热过程组成(如图所示),可以认为( )
A.
此循环过程违反热力学第一定律,但不违反热力学第二定律
B.
此循环过程违反热力学第二定律,但不违反热力学第一定律
C.
此循环过程既违反热力学第一定律,也违反热力学第二定律
D.
此循环过程既不违反热力学第一定律,也不违反热力学第二定律
题目解答
答案
B. 此循环过程违反热力学第二定律,但不违反热力学第一定律
解析
考查要点:本题主要考查热力学第一定律和第二定律在循环过程中的应用,特别是对循环过程是否违反热力学定律的判断。
解题核心思路:
- 热力学第一定律(能量守恒):循环过程的总能量变化为零,即吸热与放热的代数和等于对外做的净功。若循环能正常进行,则不违反第一定律。
- 热力学第二定律(热量传递方向与永动机限制):若循环过程中存在从低温物体向高温物体传递热量而不消耗其他能量的情况,或效率超过卡诺循环的理论最大值,则违反第二定律。
破题关键点:
- 分析循环过程的热量传递方向和做功情况。
- 判断是否存在热量自发从低温传向高温或不消耗能量却输出功的现象。
循环过程分析
假设循环由等温过程和绝热过程组成(如顺时针方向):
- 等温膨胀(吸热):系统从高温热源吸收热量 $Q_{\text{吸}}$,对外做功。
- 绝热膨胀:系统继续对外做功,温度降低。
- 等温压缩(放热):系统向低温热源释放热量 $Q_{\text{放}}$,外界对系统做功。
- 绝热压缩:系统温度回升,恢复初始状态。
热力学第一定律
循环中总内能变化 $\Delta U = 0$,因此吸热与放热的代数和等于净功 $W$:
$Q_{\text{吸}} - Q_{\text{放}} = W$
能量守恒成立,不违反第一定律。
热力学第二定律
若循环过程中存在以下情况:
- 从低温热源吸热,向高温热源放热,同时对外输出功(如制冷机),则需外界消耗能量,否则违反克劳修斯表述。
- 若循环仅从单热源吸热并对外输出功(如永动机),则违反热力学第二定律。
题目中循环若包含热量自发从低温传向高温的过程(如等温压缩时向高温热源放热),且未消耗其他能量,则违反第二定律。