题目
(14分)用能量为12.5电子伏特的电子去激发基态氢原子,问受激发的氢原子向低能级跃迁时,会出现那些波长的光谱线?
(14分)用能量为12.5电子伏特的电子去激发基态氢原子,问受激发的氢原子向低能级跃迁时,会出现那些波长的光谱线?
题目解答
答案
解:把氢原子有基态激发到你n=2,3,4……等能级上去所需要的能量是:
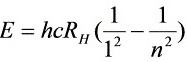 其中
其中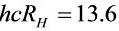 电子伏特
电子伏特
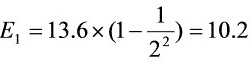 电子伏特
电子伏特
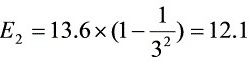 电子伏特
电子伏特
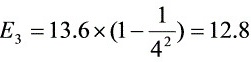 电子伏特
电子伏特
其中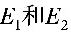 小于12.5电子伏特,
小于12.5电子伏特,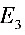 大于12.5电子伏特。可见,具有12.5电子伏特能量的电子不足以把基态氢原子激发到
大于12.5电子伏特。可见,具有12.5电子伏特能量的电子不足以把基态氢原子激发到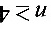 的能级上去,所以只能出现
的能级上去,所以只能出现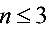 的能级间的跃迁。跃迁时可能发出的光谱线的波长为:
的能级间的跃迁。跃迁时可能发出的光谱线的波长为:
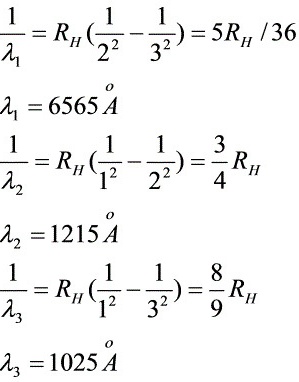
解析
考查要点:本题主要考查氢原子能级跃迁与光谱线的关系,涉及能量跃迁条件及里德伯公式的应用。
解题核心思路:
- 确定可激发的能级:根据电子能量(12.5 eV),计算基态氢原子能被激发到哪些能级(n=2、3、4等),需满足激发能量不超过电子能量。
- 分析可能的跃迁路径:激发后的氢原子向低能级跃迁时,所有可能的能级组合均会产生光谱线。
- 计算光谱线波长:利用里德伯公式,结合能级差计算各跃迁对应的波长。
破题关键点:
- 激发能级的判断:通过氢原子能级公式 $E_n = -\frac{13.6}{n^2} \, \text{eV}$,计算不同能级间的能量差,筛选出电子能量可覆盖的能级。
- 跃迁路径的穷举:确保所有可能的向下跃迁均被考虑,避免遗漏光谱线。
确定可激发的能级
氢原子基态能量为 $E_1 = -13.6 \, \text{eV}$。激发到能级 $n$ 所需能量为:
$E = 13.6 \left( 1 - \frac{1}{n^2} \right) \, \text{eV}$
代入 $n=2,3,4$:
- $n=2$:$E_2 = 13.6 \left( 1 - \frac{1}{4} \right) = 10.2 \, \text{eV}$(可激发)
- $n=3$:$E_3 = 13.6 \left( 1 - \frac{1}{9} \right) = 12.1 \, \text{eV}$(可激发)
- $n=4$:$E_4 = 13.6 \left( 1 - \frac{1}{16} \right) = 12.8 \, \text{eV}$(超过12.5 eV,不可激发)
结论:氢原子最多被激发到 $n=3$ 能级。
分析跃迁路径
从 $n=3$ 和 $n=2$ 向低能级跃迁,可能的路径为:
- $n=3 \to n=2$
- $n=3 \to n=1$
- $n=2 \to n=1$
计算光谱线波长
根据里德伯公式 $\frac{1}{\lambda} = R_H \left( \frac{1}{m^2} - \frac{1}{n^2} \right)$($n > m$),代入 $R_H = 1.097 \times 10^7 \, \text{m}^{-1}$:
- $n=3 \to n=2$:
$\frac{1}{\lambda_1} = R_H \left( \frac{1}{2^2} - \frac{1}{3^2} \right) = \frac{5}{36} R_H \implies \lambda_1 = \frac{36}{5 R_H} \approx 6565 \, \text{Å}$ - $n=3 \to n=1$:
$\frac{1}{\lambda_3} = R_H \left( \frac{1}{1^2} - \frac{1}{3^2} \right) = \frac{8}{9} R_H \implies \lambda_3 = \frac{9}{8 R_H} \approx 1025 \, \text{Å}$ - $n=2 \to n=1$:
$\frac{1}{\lambda_2} = R_H \left( \frac{1}{1^2} - \frac{1}{2^2} \right) = \frac{3}{4} R_H \implies \lambda_2 = \frac{4}{3 R_H} \approx 1215 \, \text{Å}$