题目
气缸内有1.0mol氦气,初始温度为27°,体积为20L(升),先将氦气等压膨胀,直至体积加倍,然后绝热膨胀,直至回复初温为止,把氦气视为理想气体,试求(摩尔体积常量R=8.31Jcdot (mol)^-1 cdot (K)^-1 )(1)在P-V图上大致画出气体的状态变化过程;(2)在这过程中氦气吸热多少?(3)氦气的内能变化多少?(4)氦气所做的总功是多少
气缸内有1.0mol氦气,初始温度为27°,体积为20L(升),先将氦气等压膨胀,直至体积加倍,然后绝热膨胀,直至回复初温为止,把氦气视为理想气体,试求(摩尔体积常量$$R=8.31J\cdot {mol}^{-1} \cdot {K}^{-1} $$)
(1)在P-V图上大致画出气体的状态变化过程;
(2)在这过程中氦气吸热多少?
(3)氦气的内能变化多少?
(4)氦气所做的总功是多少
题目解答
答案
(1)P-V如图: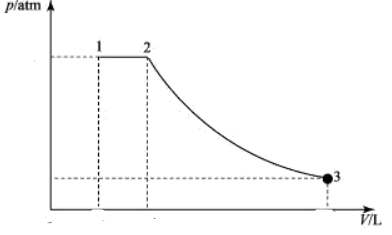
(2)$$6.25\times {10}^{3} J$$
(3)0
(4)$$6.25\times {10}^{3} J$$
解析
步骤 1:确定初始状态
氦气初始状态为:$$n=1.0mol$$,$$T_1=27^{\circ}C=300K$$,$$V_1=20L$$。根据理想气体状态方程$$PV=nRT$$,可以计算出初始状态下的压强$$P_1$$。
步骤 2:等压膨胀过程
氦气等压膨胀至体积加倍,即$$V_2=2V_1=40L$$。由于是等压过程,压强不变,即$$P_2=P_1$$。根据理想气体状态方程,可以计算出等压膨胀后的温度$$T_2$$。
步骤 3:绝热膨胀过程
氦气绝热膨胀至回复初温,即$$T_3=T_1=300K$$。根据绝热过程方程$$PV^{\gamma}=常数$$,可以计算出绝热膨胀后的体积$$V_3$$和压强$$P_3$$。
步骤 4:计算吸热
根据热力学第一定律$$\Delta U=Q-W$$,其中$$\Delta U$$为内能变化,$$Q$$为吸热,$$W$$为做功。由于氦气为单原子理想气体,其内能只与温度有关,因此$$\Delta U=0$$。根据理想气体状态方程和绝热过程方程,可以计算出做功$$W$$,从而得到吸热$$Q$$。
步骤 5:计算内能变化
由于氦气为单原子理想气体,其内能只与温度有关,因此内能变化$$\Delta U=0$$。
步骤 6:计算总功
根据理想气体状态方程和绝热过程方程,可以计算出做功$$W$$,即为氦气所做的总功。
氦气初始状态为:$$n=1.0mol$$,$$T_1=27^{\circ}C=300K$$,$$V_1=20L$$。根据理想气体状态方程$$PV=nRT$$,可以计算出初始状态下的压强$$P_1$$。
步骤 2:等压膨胀过程
氦气等压膨胀至体积加倍,即$$V_2=2V_1=40L$$。由于是等压过程,压强不变,即$$P_2=P_1$$。根据理想气体状态方程,可以计算出等压膨胀后的温度$$T_2$$。
步骤 3:绝热膨胀过程
氦气绝热膨胀至回复初温,即$$T_3=T_1=300K$$。根据绝热过程方程$$PV^{\gamma}=常数$$,可以计算出绝热膨胀后的体积$$V_3$$和压强$$P_3$$。
步骤 4:计算吸热
根据热力学第一定律$$\Delta U=Q-W$$,其中$$\Delta U$$为内能变化,$$Q$$为吸热,$$W$$为做功。由于氦气为单原子理想气体,其内能只与温度有关,因此$$\Delta U=0$$。根据理想气体状态方程和绝热过程方程,可以计算出做功$$W$$,从而得到吸热$$Q$$。
步骤 5:计算内能变化
由于氦气为单原子理想气体,其内能只与温度有关,因此内能变化$$\Delta U=0$$。
步骤 6:计算总功
根据理想气体状态方程和绝热过程方程,可以计算出做功$$W$$,即为氦气所做的总功。